题目内容
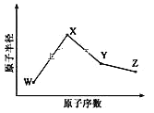
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知 W 的一种核素的质量数为18,中子数为10;X 和 Ne 的核外电子数相差1; 在Z所在的周期中,Z 元素的原子得电子能力最强;四种元素的最外层电子数之和为18。 请回答下列问题:
(1)X 元素位于元素周期表中位置为____________。
(2)Z 的同族简单氢化物中,稳定性最好的是________(写化学式),原因__________________。
(3)W、X、Z 三种元素形成的化合物中化学键类型为___________;X2W2的电子式为________。
(4)Y 与 Z 形成的化合物YZ4在常温下是一种液态,它和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式为__________________________。
(5)Z 的氧化物很多,其中一种黄绿色气体M,其氧含量为 47.41%,可用于水处理, M 在液态和浓缩气态时具有爆炸性。 M 可与 NaOH 溶液反应生成两种稳定的盐,它们的物质的量之比为 1︰5,该反应的化学方程式为____________________。
【答案】第三周期第IA族 HF 卤族元素中,氟元素的非金属最强,其氢化物最稳定 离子键、共价键 ![]() SiCl4 + 3H2O = H2SiO3↓ + 4HCl 6ClO2+6NaOH=NaCl+5NaClO3+3H2O
SiCl4 + 3H2O = H2SiO3↓ + 4HCl 6ClO2+6NaOH=NaCl+5NaClO3+3H2O
【解析】
W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,则其质子数为18-10=8,故W为O元素;X和Ne原子的核外电子数相差1,且原子半径大于氧,所以X为Na元素;Y、Z均处于第三周期,在Z所在的周期中,Z 元素的原子得电子能力最强,则Z为Cl,四种元素的最外层电子数之和为18,则Y原子最外层电子数为18-6-1-7=4,故Y为Si。
由分析可知:W为O元素、X为Na元素、Y为Si元素、Z为Cl元素;
(1)X为Na元素,位于元素周期表中第三周期第IA族;
(2)Z为Cl元素,为ⅦA族元素,同主族中F元素的非金属性最强,则HF最稳定;
(3)W、X、Z 三种元素形成的化合物为NaClO等,含有离子键、共价键;Na2O2的电子式为![]() ;
;
(4)Y与Z形成的化合物为SiCl4,和足量水反应,生成一种弱酸和一种强酸,应生成硅酸与HCl,该反应的化学方程式是:SiCl4+3H2O=H2SiO3↓+4HCl;
(5)Cl的氧化物很多,其中一种黄绿色气体M,其氧含量为47.41%,则分子中Cl、O原子数目之比为![]() =1:2,故M的化学式为ClO2,ClO2可与NaOH溶液反应生成两种稳定的盐,它们的物质的量之比为1:5,只能是部分Cl元素降低为-1价,部分升高为+5价,该反应的化学方程式为:6ClO2+6NaOH=NaCl+5 NaClO3+3H2O。
=1:2,故M的化学式为ClO2,ClO2可与NaOH溶液反应生成两种稳定的盐,它们的物质的量之比为1:5,只能是部分Cl元素降低为-1价,部分升高为+5价,该反应的化学方程式为:6ClO2+6NaOH=NaCl+5 NaClO3+3H2O。