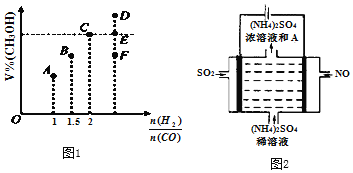
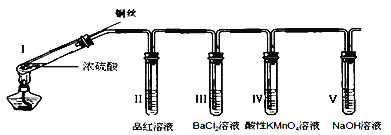
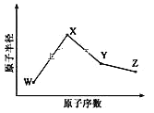
题目内容
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
A. 放电时负极失去电子,发生还原反应
B. 放电时电解质溶液中的OH-向正极移动
C. 充电时阴极附近溶液的pH减小
D. 充电时阳极反应:Ni(OH)2-e-+OH-===NiOOH+H2O
【答案】D
【解析】
A.原电池中,负极上发生失电子的氧化反应;
B.原电池中,电解质中的阴离子向负极移动;
C.电解池中,阴极发生得电子的还原反应,根据电极反应确定溶液溶液的的变化;
D.电解池中,与直流电源正极相连的电极是阳极,阳极发生失电子的氧化反应。
详解: A. 放电时是原电池工作原理,负极上发生失电子的氧化反应,故A错误;
B. 放电时是原电池的工作原理,原电池工作时,电解质中的阴离子向负极移动,故B错误;
C. 充电时是电解池的工作原理,电解池中,阴极发生得电子的还原反应,阴极附近溶液的pH增大,故C错误;
D. 充电时是电解池的工作原理,电解池中,与直流电源正极相连的电极是阳极,阳极发生失电子的氧化反应,即发生Ni(OH)2转化为NiOOH的反应,故D正确。
故选D。

【题目】原电池是化学对人类的一项重大贡献。
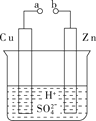
(1)某兴趣小组为研究电池原理,设计如图A装置。
|
|
A | B |
①a和b不连接时,烧杯中发生反应的离子方程式是___________________。
②a和b用导线连接,Cu极为原电池________(填“正”或“负”)极,该电极反应式是____________________________。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.4 mol电子,则理论上Zn片质量减轻________ g。
(2)如图B是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为________________。
②电池工作一段时间后电解质溶液的pH________(填“增大”“减小”或“不变”)。