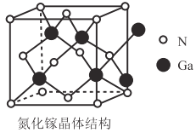
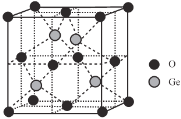
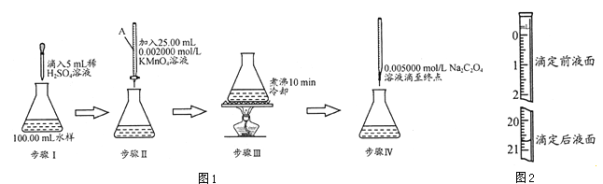
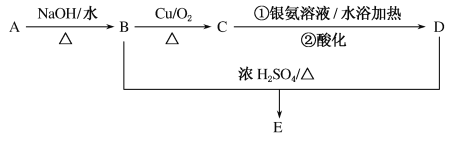
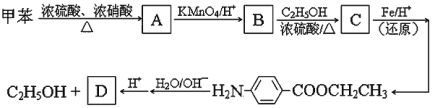
题目内容
【题目】已知X、Y是主族元素,I为电离能,单位是kJ/mol。根据下表所列数据判断错误的是

A. 元素X的常见化合价是+1价
B. 若元素Y处于第3周期,它可与冷水剧烈反应
C. 元素X与氯形成化合物时,化学式可能是XCl
D. 元素Y是ⅢA族的元素
【答案】B
【解析】试题分析:X、Y是主族元素,I为电离能,X第一电离能和第二电离能差距较大,说明X为第IA族元素;
Y第三电离能和第四电离能差距较大,说明Y为第IIIA族元素,X的第一电离能小于Y,说明X的金属活泼性大于Y;A.X为第IA族元素,元素最高化合价与其族序数相等,所以X常见化合价为+1价,故A正确;B.若元素Y处于第3周期,为Al元素,它不能与冷水剧烈反应,但能溶于酸和强碱溶液,故B错误;C.元素X与氯形成化合物时,X的电负性小于Cl元素,所以在二者形成的化合物中X显+1价、Cl元素显-1价,则化学式可能是XCl,故C正确;D.通过以上分析知,Y为第IIIA族元素,故D正确;故选B。

【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)表中最活泼的金属是__________,单质能用作半导体材料的是__________,化学性质最稳定的是__________ (填写元素符号)。
(2)表中能形成两性氢氧化物的元素是_________ (填写元素符号),分别写出该元素的氢氧化物与⑥和⑨最高价氧化物的水化物反应的化学方程式:_________________________。
(3)③与⑩组成的化合物属于__________(填“离子化合物”或“共价化合物”)用电子式表示该化合物的形成过程________________________________。①的氢化物中含有__________(填“离子键”或“极性共价键”或“非极性共价键”)的电子式是__________。
(4)⑦和⑩的氢化物中沸点较高的是__________(写化学式)原因是_________。
(5)请设计一个实验,比较⑦⑩单质氧化性的强弱:________________________________。
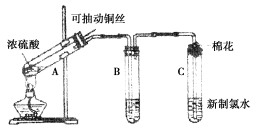
【题目】已知:实验室常用无水乙醇(CH3CH2OH)制备乙烯,制备原理为:
CH3CH2OH![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
无水乙醇性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 挥发性 | 化学性质 |
无水乙醇 | —114.1 | 78.3 | 能与水以任意比互溶 | 易挥发 | 能使酸性高锰酸钾溶液褪色 |
甲、乙同学用下列实验装置制备乙烯并验证其性质。(气密性已检验,部分夹持装置略)。

实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热至170℃ | I:A中烧瓶内液体渐渐变黑 II:B内气泡连续冒出,溶液逐渐褪色 |
…… | |
实验完毕,清洗烧瓶 | III:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)写出乙烯的1个用途: ,对应方程式为(注明反应类型) 。
(2)A中烧瓶内溶液“渐渐变黑”,说明浓硫酸具有 性。
(3)分析使B中溶液褪色的物质,甲认为是C2H4使B中溶液褪色,该反应的化学方程式为(注明反应类型) 。
(4)乙根据反应原理及现象I和III综合分析,认为产物中除乙烯外还混有乙醇、H2O、CO2和一种 “有刺激性气味”的气体X。你认为这种“有刺激性气味”气体X是 (填化学式)。
为验证气体X的存在,并证实是C2H4使B中溶液褪色,乙设计如下装置,与A连接:
设 计 | 现 象 |
与A连接的装置如下:
| C中溶液褪色,加热后又恢复红色; F中溶液褪色 |
请回答下列问题:
D中盛放的试剂是 (填化学式),不能盛放酸性KMnO4溶液的原因是(用离子方程式解释): 。