题目内容
【题目】Na2O2是一种常见的氧化剂,某同学设计了一系列实验来探究氮氧化物能否被Na2O2完全吸收。装置如下(加热装置省略):
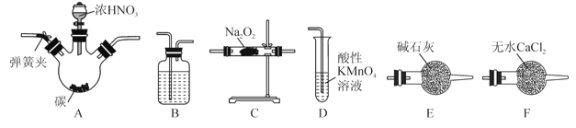
已知:
①2NO+Na2O2=2NaNO2;
②酸性条件下,NO或NO2都能与KMnO4溶液反应生成NO3-。
I.探究NO能否被Na2O2=完全吸收
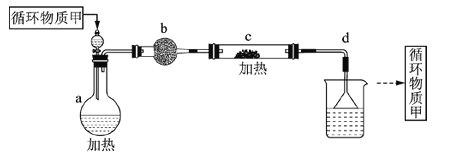
(1)所选择的装置按从左至右顺序排列依次是______________(填字母)。
(2)检査完该装置的气密性,装入药品后,实验开始前通入一段时间N2,其目的是________________。
(3)烧瓶A中反应的化学方程式为______________;D装置的作用是____________;若NO能被Na2O2完全吸收,D装置中的现象为__________________。
(4)亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛。若利利用该装置将4.68g Na2O2完全转化为NaNO2,理论上至少需要木炭的质量为_________g,为提高NaNO2的产量,在不改变实验装置的条件下,可在B中加入_________物质。
Ⅱ.探究NO2能否被NaNO2完全吸收
(5)将A中碳换为铜片,探究NO2能否被Na2O2完全吸收。若NO2与Na2O2反应只生成一种盐,则C装罝内发生反应的化学方程式为____________________。
(6)若NO2未被完全吸收,则D装置中反应的离子方程式为________________。
【答案】 A B E C D 排尽装置内空气,防止生成的 NO被O2 氧化 C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O 检验 NO 是否被完全吸收,同时可防止污染环境 酸性高锰酸钾溶液不褪色 1.08 Cu 等合理即可得分 2 NO2+Na2O2 = 2NaNO3 5NO2+MnO4-+H2O == 5NO3-+Mn2++2H+
CO2↑+4NO2↑+2H2O 检验 NO 是否被完全吸收,同时可防止污染环境 酸性高锰酸钾溶液不褪色 1.08 Cu 等合理即可得分 2 NO2+Na2O2 = 2NaNO3 5NO2+MnO4-+H2O == 5NO3-+Mn2++2H+
【解析】(1)要探究NO能否被Na2O2完全吸收,需要首先除去NO中的NO2,可以通入水中,然后再干燥,同时也需要除去CO2,然后通入过氧化钠中,最后还需要尾气处理,则所选择的装置按从左至右顺序排列依次是A、B、E、C、D。(2)装置有空气,能氧化NO,所以通入一段时间N2的目的是排尽装置内空气,防止生成的 NO被O2 氧化。(3)烧瓶A中碳和浓硝酸反应的化学方程式为C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O;根据已知信息D装置中酸性高锰酸钾溶液的作用是检验 NO 是否被完全吸收,同时可防止污染环境;若NO能被Na2O2完全吸收,D装置中的现象为酸性高锰酸钾溶液不褪色。(4)4.68gNa2O2是0.06mol,根据方程式Na2O2+2NO=2NaNO2可知消耗NO是0.12mol,则根据反应3NO2+H2O=2HNO+NO可知NO2是0.36mol,所以理论上至少需要木炭的质量为
CO2↑+4NO2↑+2H2O;根据已知信息D装置中酸性高锰酸钾溶液的作用是检验 NO 是否被完全吸收,同时可防止污染环境;若NO能被Na2O2完全吸收,D装置中的现象为酸性高锰酸钾溶液不褪色。(4)4.68gNa2O2是0.06mol,根据方程式Na2O2+2NO=2NaNO2可知消耗NO是0.12mol,则根据反应3NO2+H2O=2HNO+NO可知NO2是0.36mol,所以理论上至少需要木炭的质量为![]() 。为提高NaNO2的产量,就需要将NO2尽可能全部转化为NO,由于溶于水生成硝酸,则在不改变实验装置的条件下,可在B中加入金属铜等物质。Ⅱ.(5)若NO2与Na2O2反应只生成一种盐,根据氮元素的化合价变化可判断该盐是硝酸钠,则C装罝内发生反应的化学方程式为2NO2+Na2O2 =2NaNO3。(6)若NO2未被完全吸收,则D装置中过量的NO2被酸性高锰酸钾溶液氧化,反应的离子方程式为5NO2+MnO4-+H2O=5NO3-+Mn2++2H+。
。为提高NaNO2的产量,就需要将NO2尽可能全部转化为NO,由于溶于水生成硝酸,则在不改变实验装置的条件下,可在B中加入金属铜等物质。Ⅱ.(5)若NO2与Na2O2反应只生成一种盐,根据氮元素的化合价变化可判断该盐是硝酸钠,则C装罝内发生反应的化学方程式为2NO2+Na2O2 =2NaNO3。(6)若NO2未被完全吸收,则D装置中过量的NO2被酸性高锰酸钾溶液氧化,反应的离子方程式为5NO2+MnO4-+H2O=5NO3-+Mn2++2H+。

 名校课堂系列答案
名校课堂系列答案