题目内容
【题目】某同学为验证元素周期表中元素性质的递变规律,设计了如下实验。
I.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_____与盐酸反应最剧烈,____与盐酸反应的速率最慢;_____与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:_______________。
II.利用下图装置可验证同主族非金属性的变化规律。
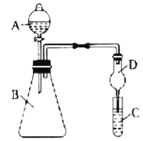
(3) 仪器A的名称为__________, B为__________,干燥管D的作用为___________。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到混合溶液_____的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_____溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液______的现象,即可证明。但有的同学认为盐酸具有挥发性,应用______溶液除去。
【答案】 钾 铝 铝 S2-+Cl2=S↓+2C1- 分液漏斗 锥形瓶 防止倒吸 变蓝 NaOH[或Ca(OH)2] 有白色沉淀生成 饱和NaHCO3
【解析】I.(1)根据金属活动性顺序表可以判断钠、钾、镁、铝的活泼性,活泼性越强,与盐酸反应越剧烈;根据电子守恒比较生成氢气体积大小;
(2)硫离子被氯气氧化成硫单质,据此写出反应的离子方程式.
II.(1)根据仪器的构造写出仪器A的名称;球形干燥管具有防止倒吸的作用;
(2)氯气能够将碘离子氧化成碘单质;氯气有毒,氯气能够与氢氧化钠溶液反应;
(3)盐酸酸性强于碳酸,二氧化碳能使石灰水变浑浊;盐酸挥发,应排除实验中干扰。
I.(1)金属活泼性顺序为:钾>钠>镁>铝,所以相同条件下与盐酸反应最激烈的是钾,反应速率最慢的是铝;生成1mol氢气需要得到2mol电子,1mol钾、钠都失去1mol电子,1mol镁失去2mol电子,而1mol铝失去3mol电子,所以生成氢气最多的是金属铝,
故答案为:钾;铝;铝;
(2)氯气氧化性强于硫单质,所以氯气能够与硫离子反应生成硫,反应的离子方程式为:S2-+Cl2═S↓+2Cl-,
故答案为:S2-+Cl2═S↓+2Cl-。
II. (1)仪器A为分液漏斗;球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中,因此,本题正确答案是:锥形瓶;防止倒吸;
(2)浓盐酸和高锰酸钾反应生成氯气,氯气具有强氧化性,可与碘化钾反应生成碘,因淀粉遇碘变蓝色,则可观察到溶液变蓝,氯气有毒,不能排放到空气中,可与氢氧化钠溶液反应而被吸收,则可用氢氧化钠溶液进行尾气吸收,少量时,也可用石灰水吸收,
因此,本题正确答案是:变蓝;NaOH[或Ca(OH)2];
(3)因碳酸比硅酸强,二氧化碳可与硅酸钠反应生成硅酸沉淀,溶液变浑浊,氯化氢具有挥发性,干扰实验结果,需要将二氧化碳中的氯化氢除掉,根据氯化氢与碳酸氢钠反应,而二氧化碳不反应,可以在B和C之间增加装有饱和NaHCO3溶液的洗气瓶,
因此,本题正确答案是:有白色沉淀生成; 饱和NaHCO3。

【题目】气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.
待测气体 | 部分电极反应产物 |
NO2 | NO |
Cl2 | HCl |
CO | CO2 |
H2S | H2SO4 |
则下列说法中正确的是( )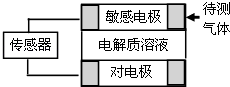
A.上述气体检测时,敏感电极均作电池正极
B.检测Cl2气体时,敏感电极的电极反应为:Cl2+2e﹣═2Cl﹣
C.检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e﹣═4OH﹣
D.检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同