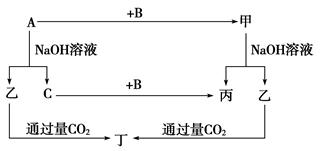
题目内容
(9分)某100mL的CuCl2溶液中,已知溶液中的Cl-的浓度为0.4mol/L。现将一定量的铁粉投入到该溶液中,回答下列问题:
(1) CuCl2的电离方程式为 , 铁粉投入后反应的离子方程式为 。
(2)原溶液中Cu2+的浓度为 mol/L。
(3)反应后测得Cl-的浓度为 mol/L。
(4)若反应后测得Fe2+的溶液为0.1mol/L,则反应生成铜单质的质量为 g。剩余的Cu2+的浓度为 mol/L。
(1) CuCl2的电离方程式为 , 铁粉投入后反应的离子方程式为 。
(2)原溶液中Cu2+的浓度为 mol/L。
(3)反应后测得Cl-的浓度为 mol/L。
(4)若反应后测得Fe2+的溶液为0.1mol/L,则反应生成铜单质的质量为 g。剩余的Cu2+的浓度为 mol/L。
(9分) (1) CuCl2=Cu2++2Cl- (1分) Fe+Cu2+=Fe2++ Cu (2分)
(2)0.2 (1分) (3)0.4 (1分) (4)0.64 (2分) 0.1(2分)
(2)0.2 (1分) (3)0.4 (1分) (4)0.64 (2分) 0.1(2分)
(1)氯化铜是电解质,在溶液中完全电离,电离方程式是 CuCl2=Cu2++2Cl-。铁的金属性强于铜的,所以能置换出铜,反应的方程式是Fe+Cu2+=Fe2++ Cu。
(2)溶液中的Cl-的浓度为0.4mol/L,则根据氯化铜的化学式可知,溶液中铜离子的浓度是0.2mol/L。
(3)氯离子不参与反应,所以反应后氯离子的浓度是不变的,还是0.4mol/L。
(4)反应后测得Fe2+的溶液为0.1mol/L,则亚铁离子的物质的量是0.1mol/L×0.1L=0.01mol,则根据方程式可知置换出的铜是0.01mol,质量是0.64g。
(2)溶液中的Cl-的浓度为0.4mol/L,则根据氯化铜的化学式可知,溶液中铜离子的浓度是0.2mol/L。
(3)氯离子不参与反应,所以反应后氯离子的浓度是不变的,还是0.4mol/L。
(4)反应后测得Fe2+的溶液为0.1mol/L,则亚铁离子的物质的量是0.1mol/L×0.1L=0.01mol,则根据方程式可知置换出的铜是0.01mol,质量是0.64g。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目