题目内容
将镁条在空气中燃烧的全部产物(MgO和Mg3N2)溶解在50mL浓度为1.8mol/L的盐酸中,以20mL0.9mol/L的NaOH溶液中和多余的酸,然后向溶液中加入过量的NaOH,把生成的氨全部蒸发出来,用足量盐酸吸收,经测定氨的质量为0.102g,回答下列问题:
(1)写出Mg3N2与盐酸反应的化学方程式__________________________________。
(2)计算原镁条的质量。
(1)写出Mg3N2与盐酸反应的化学方程式__________________________________。
(2)计算原镁条的质量。
(1)Mg3N2 + 8HCl =" 3" MgCl2 + 2 NH4Cl
(2)加入热碱前,体系是含Mg2+、Na+、NH4+、Cl-的电解质溶液。
n(Cl-)=n(HCl)=1.8 mol·L-1×0.05L=0.09mol
n(Na+)=n(NaOH)=0.9 mol·L-1×0.02L=0.018mol
n(NH4+)=n(NH3)=0.006 mol)
依电荷守恒得:2n(Mg2+)+n(Na+)+n(NH4+)=n(Cl-)
代上述数据得:n(Mg)=n(Mg2+)=0.033mol ; m(Mg)=" 0.792" g
(2)加入热碱前,体系是含Mg2+、Na+、NH4+、Cl-的电解质溶液。
n(Cl-)=n(HCl)=1.8 mol·L-1×0.05L=0.09mol
n(Na+)=n(NaOH)=0.9 mol·L-1×0.02L=0.018mol
n(NH4+)=n(NH3)=0.006 mol)
依电荷守恒得:2n(Mg2+)+n(Na+)+n(NH4+)=n(Cl-)
代上述数据得:n(Mg)=n(Mg2+)=0.033mol ; m(Mg)=" 0.792" g
考查根据方程式进行的有关计算。氮化镁和水反应生成氢氧化镁和氨气,所以和盐酸反应的方程式为Mg3N2 + 8HCl =" 3" MgCl2 + 2 NH4Cl 。

练习册系列答案
 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
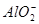 +6H2O=4Al(OH)3↓,正确的做法是
+6H2O=4Al(OH)3↓,正确的做法是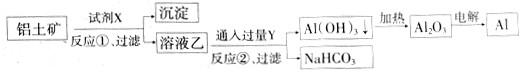

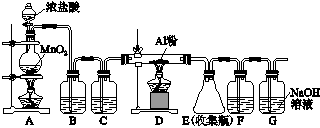
 测定生成气体的体积
测定生成气体的体积 测定生成气体的体积
测定生成气体的体积 溶液
溶液
 称量灼烧产物的质量。
称量灼烧产物的质量。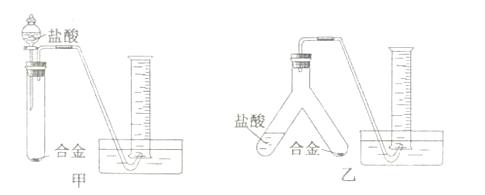
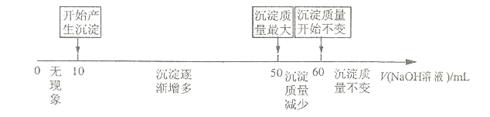
 溶液时,生成沉淀的质量与加入
溶液时,生成沉淀的质量与加入