题目内容
(1)实验室通常用NH4Cl固体与其它碱性物质混合加热制取氨气.
①写出实验室制取氨气的反应方程式
| ||
| ||
②将酚酞溶液滴加到氨水中溶液呈红色,其原因是
 NH4-+OH-
NH4-+OH- NH4-+OH-
NH4-+OH-③浓氨水可以用来检验有毒气体(如:氯气)的泄漏,反应式为3Cl2+8NH3═N2+6NH4Cl,在该反应中,氧化剂是
(2)用浓氯化铵溶液处理过的舞台幕布不易着火,其原因是
①幕布的着火点升高 ②幕布的质量增加
③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
A.①②B.③④C.①③D.②④
(3)实验室还用NH4Cl溶液与饱和的NaNO2溶液反应制取纯净的氮气,反应式为:
NaNO2+NH4Cl=NaCl+N2↑+2H2O
实验装置如图所示,试回答:

①装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是
a.防止饱和溶液蒸发 b.保证实验装置不漏气
c.使饱和NaNO2溶液容易滴下
②B部分的作用是
a.冷凝 b.冷却氮气 c.缓冲氮气流
③加热前必须进行的一个操作步骤是
④收集N2最适宜的方法是
a.用排气法收集在集气瓶中
b.用排水法收集在集气瓶中
c.直接收集在球胆或塑料袋中.
②氨水中存在一水合氨,可电离出铵根离子和氢氧根离子,溶液呈碱性;
③根据化合价的变化判断相关概念并计算转移的电子的数目;
(2)在加热条件下,氯化铵分解,为吸热反应,生成氨气和氯化氢气体可隔绝空气;
(3)①分液漏斗与蒸馏烧瓶之间连接的导管,可使烧瓶内压强与分液漏斗压强相等;
②B中装有冰盐,可起到冷凝的作用;
③制备气体,在实验前一定要检验气密性;
④氮气密度可空气相接近,不能用排空法收集,收集纯净的氮气,可用球胆或塑料袋直接收集.
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
②氨水中存在一水合氨,可电离出铵根离子和氢氧根离子,方程式为NH3?H2O
 NH4-+OH-,故答案为:NH3?H2O
NH4-+OH-,故答案为:NH3?H2O NH4-+OH-;
NH4-+OH-;③反应3Cl2+8NH3═N2+6NH4Cl中,Cl元素化合价降低,N元素化合价升高,Cl2为氧化剂,生成氯化铵,可观察到有白烟生成,当有1mol氮气生成时,转移的电子数是6×(1-0)mol=6mol,故答案为:Cl2;大量白烟;6;
(2)在加热条件下,氯化铵分解,为吸热反应,生成氨气和氯化氢气体可隔绝空气,达到舞台幕布不易着火的目的,故答案为:B;
(3)①分液漏斗与蒸馏烧瓶之间连接的导管,可使烧瓶内压强与分液漏斗压强相等,使饱和NaNO2溶液容易滴下,故答案为:c;
②B中装有冰盐,可起到冷凝的作用,故答案为:a;
③制备气体,在实验前一定要检验气密性,故答案为:检查装置的气密性;
④氮气密度可空气相接近,不能用排空法收集,收集纯净的氮气,可用球胆或塑料袋直接收集,而用排水法不能得到纯净氮气,故答案为:c.

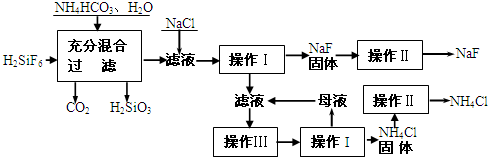
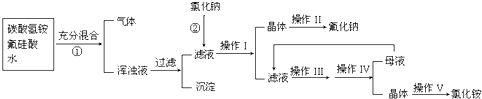
氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂和生产含氟牙膏等。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:

有关物质在水中溶解度(g/100gH2O)如下:
|
温度 |
10℃ |
20℃ |
30℃ |
溶解度:20℃NaF—4 0℃NH4F—100; 常温Na2SiF6微溶于水 |
|
NH4Cl溶解度 |
33.3 |
37.2 |
41.4 |
请回答下列问题:
(1)操作Ⅰ需要用到的玻璃仪器有 。
(2)上述流程中发生两步反应,化学方程式为 ,
。
(3)操作II的作用是 ,
操作Ⅲ的具体过程是 。
(4)流程中NH4HCO3必须过量,其原因是
_______________________________________________________________________。
(15分)氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂和生产含氟牙膏等。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:
有关物质在水中溶解度(g/100gH2O)如下:
|
温度 |
10℃ |
20℃ |
30℃ |
溶解度:20℃NaF—4 0℃NH4F—100; 常温Na2SiF6微溶于水 |
|
NH4Cl溶解度 |
33.3 |
37.2 |
41.4 |
请回答下列问题:
(1)操作Ⅰ需要用到的玻璃仪器有 。
(2)上述流程中发生两步反应,化学方程式为:
(3)操作II的作用是
操作Ⅲ的具体过程是
(4)流程中NH4HCO3必须过量,其原因是
_______________________________________________________________________