题目内容
一定温度条件下,在固定体积的密闭容器中发生反应 A(s)+2B(g)?C(g)+D(g),能说明该反应达到平衡状态的标志是( )
分析:当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理性不变,以此解答该题.
解答:解:A.该反应是一个反应前后气体体积不变的反应,无论该反应是否达到平衡状态,压强始终不变,所以不能根据平衡体系的总压判断是否达到平衡状态,故A错误;
B.当达到平衡状态时,各物质的浓度不再变化,则平衡混合气体的平均相对分子质量不变,所以能平衡达到平衡状态,故B正确;
C.该反应无论是否达到平衡状态,C和D的物质的量始终相等,所以不能判断是否达到平衡状态,故C错误;
D.该反应是一个反应前后气体体积不变的反应,无论该反应是否达到平衡状态,混合气体的总物质的量始终不变,所以不能判断是否达到平衡状态,故D错误;
故选B.
B.当达到平衡状态时,各物质的浓度不再变化,则平衡混合气体的平均相对分子质量不变,所以能平衡达到平衡状态,故B正确;
C.该反应无论是否达到平衡状态,C和D的物质的量始终相等,所以不能判断是否达到平衡状态,故C错误;
D.该反应是一个反应前后气体体积不变的反应,无论该反应是否达到平衡状态,混合气体的总物质的量始终不变,所以不能判断是否达到平衡状态,故D错误;
故选B.
点评:本题考查化学平衡状态的判断,题目难度不大,易错选项是B,注意虽然容器的体积不变,但反应前后气体的总质量发生变化,所以平均相对分子质量发生变化,所以可以据此判断是否达到平衡状态.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
右图表示可逆反应A(固)+B(气) nC(气);△H=Q(n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。
nC(气);△H=Q(n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。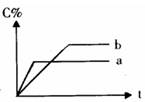
下列有关叙述中一定正确的是( )
| A.其他条件相同,a表示使用了催化剂,b没有使用催化剂 |
| B.其他条件相同,若只改变温度,则a比b的温度高且△H>0 |
| C.其他条件相同,若只改变压强,则a比b的压强大且n≥2 |
| D.其他条件相同,若改变A的物质的量,则a比b用A的物质的量少 |
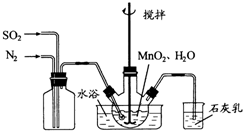 (2010?江苏)高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(2010?江苏)高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下: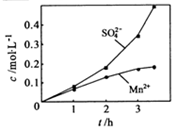
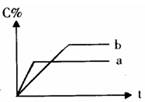 右图表示可逆反应A(固)+B(气)
右图表示可逆反应A(固)+B(气)