题目内容
某铁的“氧化物”样品,用5mol/L的盐酸140mL恰好完全溶解,所得溶液还能吸收标准状况下0.56L氯气,使其中Fe2+全部转化为Fe3+。该样品可能的化学式是 ( )
| A.Fe2O3 | B.Fe3O4 | C.Fe4O5 | D.Fe5O7 |
D
 利用正、负电荷相等列方程可快速解题。
利用正、负电荷相等列方程可快速解题。 设铁的氧化物中含O2-为xmol,则其化学式为FexOy,由O2-个数守恒有:
设铁的氧化物中含O2-为xmol,则其化学式为FexOy,由O2-个数守恒有: 2yH++ FexOy = yH2O+ xFe+(2y/x)
2yH++ FexOy = yH2O+ xFe+(2y/x) 2ymol ymol
2ymol ymol 0.7mol amol
0.7mol amol 2y:y=0.7:a a=0.35(mol)
2y:y=0.7:a a=0.35(mol) 设FexOy中含Fe2+bmol,则:
设FexOy中含Fe2+bmol,则: 2Fe2++ Cl2 = Fe3++ 2Cl-
2Fe2++ Cl2 = Fe3++ 2Cl-  2mol 22.4L
2mol 22.4L bmol 0.56L
bmol 0.56L 2:b=22.4:0.56 b=0.05(mol)
2:b=22.4:0.56 b=0.05(mol) 设样品FexOy中含Fe3+为cmol,则由电荷守恒可得:
设样品FexOy中含Fe3+为cmol,则由电荷守恒可得: (2×0.05mol)×3cmol=2×0.35mol
(2×0.05mol)×3cmol=2×0.35mol 解之得c=0.2mol
解之得c=0.2mol 故样品FexOy中:x:y=(0.05+0.02):0.35=5:7
故样品FexOy中:x:y=(0.05+0.02):0.35=5:7 即样品“氧化铁”化学式为:Fe5O7。
即样品“氧化铁”化学式为:Fe5O7。
练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
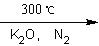 (C5H5)2 Fe+H2。
(C5H5)2 Fe+H2。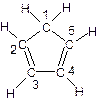 (图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),
(图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),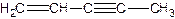 是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
 (1)铜与浓硝酸反应的化学方程式:_______________________;
(1)铜与浓硝酸反应的化学方程式:_______________________;