题目内容
7.氧化还原反应的实质是( )| A. | 分子中的原子重新组合 | B. | 氧元素的得失 | ||
| C. | 电子的得失或共用电子对的偏移 | D. | 化合价的升降 |
分析 氧化还原反应的特征是化合价的变化,化合价的变化是电子的转移的外在表现,据此分析解答.
解答 解:氧化还原反应的特征是化合价的变化,化合价的变化是电子的转移的外在表现,电子从化合价升高的元素到转移化合价降低的元素,所以氧化还原反应的实质是电子的得失或偏移.
故选C.
点评 本题考查了氧化还原反应的实质,难度不大,注意氧化还原反应的特征是化合价的变化,氧化还原反应的实质是电子的得失或偏移.

练习册系列答案
相关题目
17.下列鉴别方法不可行的是( )
| A. | 只用溴水一种试剂鉴别苯、己烯、乙醇、四氯化碳 | |
| B. | 用银氨溶液或NaHCO3溶液鉴别甲酸甲酯和乙酸两种液体 | |
| C. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO |
18.下列各组离子一定能大量共存的是( )
| A. | NH4+、H+、HCO3-、Cl- | B. | Fe3+、K+、CO32-、NO3- | ||
| C. | K+、Al3+、Cl-、OH- | D. | K+、Ba2+、NO3-、OH- |
12.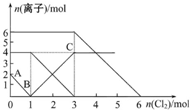 向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中正确的是( )
向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中正确的是( )
 向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中正确的是( )
向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中正确的是( )| A. | 离子的还原性顺序为:Fe2+>I->Br- | |
| B. | 原混合溶液中FeBr2的物质的量为4mol | |
| C. | 原溶液中:n(Fe2+):n(I-):n(Br-)=1:2:3 | |
| D. | 当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- |
16.下列事实对应的离子方程式书写正确的是( )
| A. | 酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| B. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 纯碱溶液能清洗油污:CO32-+2H2O?H2CO3+2OH- | |
| D. | 将过量的铁粉加入稀硝酸中:Fe+4H++NO3-═Fe3++NO↑+2H2O |
17.在①乙烷;②氯乙烯(CH2=CHCl);③溴苯;④甲苯四种有机化合物中,分子内所有原子均在同一平面的是( )
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |

 .
. .
.