题目内容
阅读下列材料:过氧化氢(H2O2)又称双氧水,常温下它是一种液体,它难电离,且易分解。作为一种经典化工产品,工业上早在100多年前便开始生产。随着社会需求的增长,尤其是生态环境保护的需要,过氧化氢近年来更受到人们的青睐,并称其为绿色氧化剂。为了贮存、运输、使用的方便,工业上采用“醇析法”将其转化为固态的过碳酸钠晶体(其化学式为2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。“醇析法”的生产工艺过程如下:在0—5 ℃下,往饱和的Na2CO3溶液中,先加入H2O2和稳定剂(MgCl2和Na2SiO3),经充分反应后,再加入异丙醇,过滤分离,即得过碳酸钠晶体。
根据上述材料,完成下列问题:
(1)依据你已有的知识,写出H2O2的结构式__________,固态时属于__________晶体。
(2)你认为H2O2被称为绿色氧化剂的主要原因是:____________________________。
(3)我们知道,稀硫酸不与铜反应,但在稀硫酸中加入H2O2后,则可使铜顺利溶解,写出该反应的离子方程式_______________________________________。
(4)稳定剂能反应生成难溶物将过碳酸钠粒子包裹住,该反应的化学方程式为:________
___________________________________________。
(5)加入异丙醇的作用是____________________________________________。
(6)下列物质不会使过碳酸钠失效的是______________。
A.MnO2 B.H2S C.CH3COOH D.NaHCO3
(7)向含有酚酞的NaOH溶液中滴加双氧水,溶液由红色褪至无色,主要原因是双氧水的________性。
(8)将双氧水加入经酸化的高锰酸钾溶液中,溶液的紫红色消褪了,此时双氧水表现出________性;若用H218O2的双氧水与酸化的高锰酸钾反应,18O将存在生成物________里。
(9)久置的油画,白色部位(PbSO4)常会变黑(PbS),用双氧水揩擦后又恢复原貌,有关反应的化学方程式为_________________________________。若有0.1 mol的PbS参与反应,则在此反应中发生转移的电子为________mol。
(1)H—O—O—H 分子
(2)H2O2的还原产物是H2O,反应时不产生污染物
(3)Cu+H2O2+2H+====Cu2++2H2O
(4)MgCl2+Na2SiO3====MgSiO3↓+2NaCl
(5)降低过碳酸钠的溶解度,有利于晶体的析出
(6)D
(7)氧化
(8)还原 18O2(氧气)
(9)PbS+4H2O2====PbSO4+4H2O 0.8
解析:(6)注意提取题中信息“具有Na2CO3和H2O2的双重性质”,即能与Na2CO3、H2O2反应的可使之失效。(8)高锰酸钾酸性溶液的氧化性比H2O2强,将H2O2氧化为O2和H2O。

 名校课堂系列答案
名校课堂系列答案
| |||||||||||||||||||||||||||||
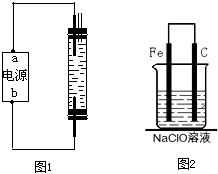 (2010?烟台一模)2008年5月12日我国四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒液,如NaClO溶液.某校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究.
(2010?烟台一模)2008年5月12日我国四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒液,如NaClO溶液.某校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究.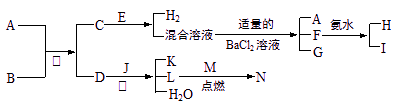 A到N为中学化学常见物质或该物质的水溶液,且它们之间存在如下转化关系
A到N为中学化学常见物质或该物质的水溶液,且它们之间存在如下转化关系