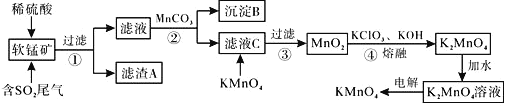
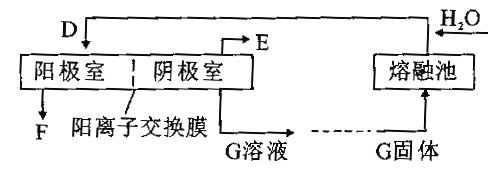
��Ŀ����
����Ŀ��ij�������ﺬNH4I��NaHCO3��AlCl3��MgBr2��FeCl2�еļ���,Ϊȷ���ù�������ijɷּ�����ɳɷֵ����ʵ���֮��,�ֽ�������ʵ�顣
ʵ����:

(1)��ɫ����Ϊ_______��
(2)�ù�������ijɷ�Ϊ_______��
ʵ����:ȡһ�����ĸù�����������ˮ���1 L��Һ,����û����Һ��ͨ��һ������Cl2,�����Һ�м���������(�ֱ���A-��B-��C-��ʾ)�����ʵ�����ͨ��Cl2����Ĺ�ϵ�����ʾ��

(3)a=____��
(4)ԭ���������и���ɳɷֵ����ʵ���֮��Ϊ_________��
���𰸡�NH3 NH4I��MgBr2��AlCl3 0.15 n(AlCl3)��n(MgBr2)��n(NH4I)=20��45��24
��������
(1)�������NaOHŨ��Һ�����ȣ����ɵ���ɫ����ֻ����NH3��˵��һ������NH4I�����Ա���𰸣� NH3��
(2)�������NaOHŨ��Һ�����ɵİ�ɫ���������ޱ仯��˵��һ����FeCl2��һ����MgBr2��������ɫ��Һ������ϡ��������ɫ�������ӹ���ϡ�����������ܽ⣬�����ݲ������Ƴ���AlCl3��NaHCO3�����Ա���𰸣� NH4I��MgBr2��AlCl3��
(3) ��Һ�������ӻ�ԭ��ǿ��˳��ΪI->Br->Cl-�������2.8L���������ʵ���Ϊ2.8L��22.4Lmol-1=0.125mol��ͨ��0.125mol ����ʱ��Һ����I-������Br-û�вμӷ�Ӧ������Һ��n(Br-)=1.5mol,����n(B)Ϊ�����ӣ���Һ��������Ϊͨ���������ɵĺ�ԭ����Һ�д��ڵģ�����A-����ΪCl-,C-����ΪI-���ӣ�Clԭ���غ��ԭ��n(Cl-)=1.25mol-0.125mol��2=1mol��ͨ��5.6L�������ʵ���=5.6L��22.4L/mol=0.25mol����ʱ��Һ��û��I-�����������ȫ��Ӧ����n(Br-)=1.4mol��˵����0.1mol�����Ӳμӷ�Ӧ�����������ȫ��Ӧ������ת�Ƶ�����ȵ�n(I-)=0.25mol��2-0.1mol��1=0.4mol,���ݷ�Ӧ:Cl2+2I-�TI2+2Cl-���÷�Ӧ������0.25mol ���������ĵ�����,����a=0.4mol-0.25mol=0.15mol������𰸣�0.15��
(4)������֪��ԭ�����Һ��n(Cl-)=1.25 mol-0.125 mol��2=1 mol��n(Br-)=1.5 mol��n(I-)=0.15 mol+0.125 mol��2=0.4 mol����n(AlCl3)��n(MgBr2)��n(NH4I)=[n(Cl-)/3]��[n(Br-)/2]��n(I-)=1/3mol��1.5/2mol��0.4 mol=20��45��24��
���Ա���𰸣�n(AlCl3)��n(MgBr2)��n(NH4I)=20��45��24��

 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�