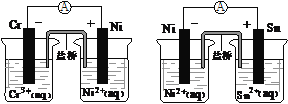
题目内容
【题目】欲用98%的浓硫酸(ρ=1.84g·cm-1)配制为1mol·L-1的稀硫酸100ml。
(1)选用的主要仪器有:
①玻璃棒,②_________,③胶头滴管,④量筒,⑤__________。
(2)需要用量筒量取98%的浓硫酸________ml。
(3)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4
B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线
D.洗净2~3次并转入容量瓶
E.稀释浓H2SO4
F.将溶液转入容量瓶
其操作正确的顺序依次为_____________________。
(4)简要回答下列问题:
①如果实验室有10mL、20mL、50mL的量筒,则所需的浓硫酸应选用____________mL的量筒最好
②任何实验都有误差,下列哪些操作会使所配的溶液浓度偏大____________
A.配置前,量取浓硫酸时发现量筒不干净用水洗净后直接量取
B.将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌,若搅拌过程中有液体溅出
C.在转入容量瓶前烧杯中液体未冷却至室温
D.洗涤烧杯和玻璃棒2~3次,洗涤液未转入容量瓶
E.定容时俯视
【答案】(1)100mL容量瓶、烧杯 (2) 5.4 (3)AEFDCB (4)①10 ②CE
【解析】试题分析:(1)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,由提供的仪器可知还需要仪器有:100mL容量瓶、烧杯;
(2)浓H2SO4的物质的量浓度c=![]() mol/L=18.4mol/L,根据稀释定律,稀释前后溶质硫酸的物质的量不变,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=100mL×1mol/L,解得:x≈5.4mL;
mol/L=18.4mol/L,根据稀释定律,稀释前后溶质硫酸的物质的量不变,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=100mL×1mol/L,解得:x≈5.4mL;
(3)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,操作正确的顺序依次为AEFDCB;
(4)①量取5.4mL浓硫酸,需要使用10mL的量筒;②A.量取时发现量筒不干净用水洗净后直接量取,浓硫酸被蒸馏水稀释,导致浓硫酸的浓度偏低;B.在配制过程中将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌,防止爆沸,迅速散热,若搅拌过程中有液体溅出,会导致溶质硫酸的物质的量偏低,配制的溶液浓度偏低;C.浓硫酸稀释放热,溶液的温度升高,转移前必须冷却稀释的溶液,否则导致配制的溶液温度较高,体积偏大,冷却后配制的溶液的体积偏低,最终导致浓度偏高;D.洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,否则会否则配制的溶液中,溶质物质的量减小,浓度偏低;E.定容时俯视,液面低于刻度线,溶液浓度偏高;故选CE。

【题目】
成分 | 质量(g) | 摩尔质量(g ·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
⑴下列“鲜花保鲜剂”的成分中,属于非电解质的是 。
A、蔗糖 B、硫酸钾 C、高锰酸钾 D、硝酸银
⑵“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为 mol.L-1。(只要求写表达式,不需要计算)
⑶配制上述1 L“鲜花保鲜剂”所需的仪器有:烧杯、玻璃棒、药匙、 、 、 。(在横线上填写所缺仪器的名称)
⑷在溶液配制过程中,下列操作正确且对配制结果没有影响的是 。
A.将药品放入容量瓶中加蒸馏水溶解
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理