题目内容
【题目】【2017届北京市西城区高三上学期期末考试】25℃时,向10 mL 0.1 mol·L-1 NH4HSO4溶液中逐滴滴入0.1 mol·L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如右图所示:
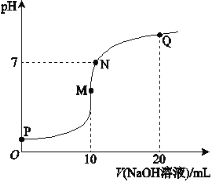
(1)用电离方程式表示P点pH<7的原因是________。
(2)M、Q两点中,水的电离程度较大的是________点。
(3)下列关系中,正确的是________。
a.M点c(Na+)>c(NH4+)
b.N点c(NH4+)+c(Na+)=2c(SO42-)
c.Q点c(NH4+)+c(NH3·H2O)=c(Na+)
【答案】
(1)NH4HSO4=NH4++H++SO42-或HSO4-=H++SO42-
(2)M(3)ab;
【解析】
试题分析:(1)NH4HSO4溶液中存在NH4HSO4 = NH4+ + H+ + SO42-,因此P点pH<7,故答案为:NH4HSO4 = NH4+ + H+ + SO42-;
(2)M点,溶质为硫酸钠和(NH4)2SO4的混合物,(NH4)2SO4水解,促进水的电离,Q点溶质为一水合氨、硫酸钠,一水合氨的电离抑制水的电离,水的电离程度较大的是M点,故答案为:M;
(3)a. M点溶质为硫酸钠和(NH4)2SO4的混合物,铵根离子水解,c(Na+) > c(NH4+),正确;b. N点溶液呈中性,根据电荷守恒,c(NH4+) + c(Na+) = 2c(SO42-),正确;c. Q点溶质为等物质的量一水合氨、硫酸钠,根据物料守恒,2c(NH4+) +2 c(NH3·H2O) = c(Na+),错误;故选ab。

 阅读快车系列答案
阅读快车系列答案【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | R |
利用表中元素回答下列问题:
(1)X元素在周期表中的位置为__________。
(2)气态氢化物水溶液呈碱性的元素是_____________,此氢化物的电子式__________。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是__________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(4)![]() 和
和![]() 是元素R的两种稳定的天然同位素,它们的原子质量分别为a g和b g,在自然界中所占的原子百分比分别为m%和n%,已知12C原子的质量为w g,则
是元素R的两种稳定的天然同位素,它们的原子质量分别为a g和b g,在自然界中所占的原子百分比分别为m%和n%,已知12C原子的质量为w g,则![]() 的相对原子质量的表达式为___________,元素R的相对原子质量的表达式为______________________。
的相对原子质量的表达式为___________,元素R的相对原子质量的表达式为______________________。
(5)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/L NaOH溶液和1mol O2,则两种气体中相对分子质量较大的气体的分子式及物质的量为__________、_____________,生成硫酸铜的物质的量为__________。