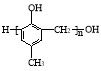
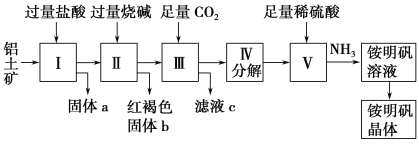
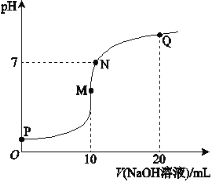
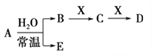题目内容
【题目】下列各组物质的晶体中,晶体类型、化学键类型均完全相同的是( )
A.SO2和SiO2
B.CCl4和KCl
C.NaOH和CaCl2
D.CO2和H2S
【答案】D
【解析】解:A、SO2是分子晶体,而SiO2是原子晶体,两者都含共价键,故A错误;B、CCl4是共价键形成的分子晶体,而KCl是离子键形成离子晶体,两者化学键的类型不同,故B错误;
C、NaOH是含有离子键和共价键形成的离子晶体,而CaCl2是离子键形成的离子晶体,所以化学键的类型不同,故C错误;
D、CO2和H2S都共价键形成的分子晶体,故D正确;
故选D.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
【题目】80℃时,NO2(g)+SO2(g)![]() SO3(g)+ NO (g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
SO3(g)+ NO (g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol L-1 | 0.10 | 0.20 | 0.20 |
C(SO2)/ mol L-1 | 0.10 | 0.10 | 0.20 |
A. 容器甲中的反应在前2 min的平均速率v(SO2)=0.05 mol L-1 min-1
B. 达到平衡时,容器丙中正反应速率与容器甲相等
C. 温度升至90℃,上述反应平衡常数为1.56,则反应的△H>0
D. 容器乙中若起始时改充0.10 molL-1 NO2和0.20molL-1 SO2,达到平衡时c(NO)与原平衡相同