题目内容
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )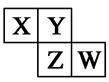
| A.X的最常见气态氢化物的水溶液显酸性 |
| B.最高价氧化物对应水化物的酸性W比Z强 |
| C.Z的单质与氢气反应较W剧烈 |
| D.X的原子半径小于Y |
B
解析试题分析:X、Y、Z、W均为短周期元素,Z原子的最外层电子数是第一层电子数的3倍,则Z的第一层电子数为2,最外层电子数为6,所以Z应为S,结合位置可知,Y为O,X为N,W为Cl,A、X的最常见气态氢化物为氨气,其水溶液显碱性,错误;B、非金属性Cl>S,则最高价氧化物对应水化物的酸性W比Z强,正确;C、非金属性Cl>S,则W的单质与氢气反应较Z剧烈,错误;D、同周期从左至右原子半径减小,则X的原子半径大于Y,错误。
考点:考查位置、结构、性质的关系及其应用。

练习册系列答案
相关题目
下列关于原子结构、元素性质的说法正确的是 ( )
| A.ⅠA族金属元素是同周期中金属性最强的元素 |
| B.非金属元素组成的化合物中只含共价键 |
| C.同种元素的原子均有相同的质子数和中子数 |
| D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
短周期Y元素的p轨道上有3个未成对电子,则该元素的最高价氧化物的水化物的化学式可能是
| A.H3YO4 | B.H4YO4 | C.HYO2 | D.H2YO4 |
下列说法正确的是
| A.第三周期从左到右,各元素形成的简单离子半径逐渐减小 |
| B.共价化合物中一定含极性共价键,可能含非极性共价键 |
| C.第ⅦA族元素从上到下,其气态氢化物的稳定性和还原性均逐渐增强 |
| D.可能存在基态核外电子排布式为1s22s22p63s23p64s24p5的原子 |
实际存在的11H、12H、13H 、H+和H2,它们是
| A.氢的五种同位素 | B.氢元素的五种不同微粒 |
| C.氢的五种核素 | D.五种氢元素 |
如图是元素周期表的一部分,下列关系正确的是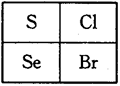
| A.还原性:Se2->S2->Cl- |
| B.热稳定性:HCl>H2Se>HBr |
| C.原子半径:Se>Cl>S |
| D.酸性:HBrO4>HClO>H2SO4 |
下表列出了A~G7种元素在周期表中的位置:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | C | D | E | | |
| 3 | | | B | | | | F | G |
| 4 | A | | | | | | | |
(1)分别写出A、D、G的元素符号: 、 、 ,其中化学性质最不活泼的是 (填元素符号);
(2)F的氢化物中化学键的类型是 ,F的最高价氧化物对应的水化物的化学式是 ;
(3)C、D、E三种元素中,氢化物种类最多的是 ;
(4)写出B与F形成的化合物发生水解反应的离子方程式 ;
由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实最能够说明这个结论的是 ( )
| A.已经制得了 IBr、ICl 等卤素互化物 |
| B.已经制得 I2O5 等碘的氧化物 |
| C.已经制得了I (NO3)3、I (ClO4)3·2H2O等含 I3+ 离子化合物 |
| D.碘(I2)易溶于KI等碘化物溶液,形成I3- 离子 |