题目内容
.甲醛是一种重要的化工产品,可以利用甲醇脱氢制备,反应式如下:
①CH30H(g)=CH20(g)+H2(g) △H1=+84.2kJ·mol-1
向反应体系中通入氧气,通过反应②2H2(g)+O2(g)=2H2O(g) △H2=-483.6 kJ·mol-1 提供反应①所需热量,要使反应温度维持在700°c,则进料中甲醇与氧气的物质的量之比为
A.5.74:1 B.11.48:1 C.1:l D.2:l
A
【解析】要使反应温度维持在700°c即反应②放出的热与反应①所需热量相等,即84.2x=483.6
X=5.74,选A。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案A.生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式_________________________。
(2)根据等电子原理,写出CO分子的结构式______________________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是_____________________;甲醛分子中碳原子轨道的杂化类型为_____________________。
②甲醛分子的空间构型是_____________________;1 mol甲醛分子中σ键的数目为_____________________。
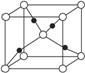
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为_____________________。
B.环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
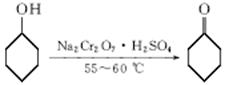
环己醇、环己酮和水的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g·cm-3, | 溶解性 |
环己醇 | 161.1(97.8)* | 0.962 4 | 能溶于水 |
环己酮 | 155.6(95)* | 0.947 8 | 微溶于水 |
水 | 100.0 | 0.998 2 |
|
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55~
①酸性Na2Cr2O7溶液的加料方式为_____________________。
②蒸馏不能分离环己酮和水的原因是_____________________。
(2)环己酮的提纯需要经过以下一系列的操作:a.蒸馏,收集151~
①上述操作的正确顺序是_______________________(填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需_______________。
③在上述操作c中,加入NaCl固体的作用是_______________________________________
______________________________________________________________________________。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有______________种不同化学环境的氢原子。
 (2010?陕西模拟)由CO与H2催化合成甲醇是生物质能利用的方法之一.
(2010?陕西模拟)由CO与H2催化合成甲醇是生物质能利用的方法之一.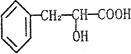
 由CO与H2催化合成甲醇是生物质能利用的方法之一.
由CO与H2催化合成甲醇是生物质能利用的方法之一.