��Ŀ����
����Ŀ����֪������(H3PO3)�Ľṹ��ͼ![]() ������ǿ��ԭ�Ե����ᣬ���Ա�����������Ϊ���ᡣ
������ǿ��ԭ�Ե����ᣬ���Ա�����������Ϊ���ᡣ
��1����֪���������PCl3ˮ����ɣ���д����Ӧ�����ӷ���ʽ____________��
��2��Na2HPO3��________(����Ρ�����ʽ�Ρ�)��
��3���������������ӷ�Ӧʱ�������뻹ԭ�������ʵ���֮��Ϊ______________��
��4��ij�¶��£�0.10molL-1��H3PO3��Һ��pHΪ1.6����c(H+)=2.5��10-2molL-1�����¶���H3PO3��һ������ƽ�ⳣ��Ka1=___________________��(H3PO3�ڶ���������Բ��ƣ����������λ��Ч����)
��5����H3PO3��Һ�еμ�NaOH��Һ�����ԣ�������Һ�У�c(Na+)_____c(H2PO3-)+2c(HPO32-)(���������������=��)��
��6����ijŨ�ȵ��������еμ�NaOH��Һ����pH����Һ�е�H3PO3��H2PO3-��HPO32-�����ʵ�������a(X)��ƽ��ʱij���ֵ�Ũ������������Ũ��֮�͵ı�ֵ)�Ĺ�ϵ��ͼ��ʾ��
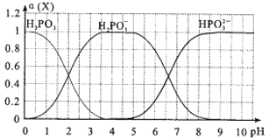
�Է�̪Ϊָʾ��������Һ����ɫ��Ϊdz��ɫʱ��������Ҫ��Ӧ�����ӷ���ʽ��_________________________��
���𰸡�PCl3+3H2O��H3PO3+3H++3Cl- ���� 2��1 8.3��10-3 mol��L-1 = H2PO3-+OH-��HPO32-+H2O
��������
(1)PCl3ˮ�����ȡ����������
(2)����������(H3PO3)�Ľṹ![]() ���ṹ�к���2���ǻ����Ƕ�Ԫ���
���ṹ�к���2���ǻ����Ƕ�Ԫ���
(3)������(H3PO3)����ǿ��ԭ�Ե����ᣬ���Ա�����������Ϊ���ᣬAg+����ԭ����Ag������ת�Ƶ����غ�����������뻹ԭ�������ʵ���֮�ȣ�
(4)��������Һ����̶Ƚ�С�����Ը���Һ�д���c(H2PO3-)��c(H+)=2.5��10-2molL-1��c(H3PO3)=(0.10-2.5��10-2)mol/L����ϵ���ƽ�ⳣ������ʽ���㣻
(5)��H3PO3��Һ�еμ�NaOH��Һ�����ԣ���c(H+)=c(OH-)����ϵ���غ��жϣ�
(6)��̪�ı�ɫ��ΧΪ8-10���Է�̪Ϊָʾ��������Һ����ɫ��Ϊdz��ɫʱ����Һ��pH����8������ͼ����Һ��H2PO3-ת��ΪHPO32-���ݴ���д��Ӧ�ķ���ʽ��
(1)PCl3ˮ�����ȡ����������ᣬ��Ӧ�����ӷ���ʽΪPCl3+3H2O��H3PO3+3H++3Cl-���ʴ�Ϊ��PCl3+3H2O��H3PO3+3H++3Cl-��
(2)����������(H3PO3)�Ľṹ![]() ���ṹ�к���2���ǻ����Ƕ�Ԫ���ᣬ��ö�Ԫ��������������������ӣ�Na2HPO3�Ǹö�Ԫ�����е�Hԭ�Ӳ��ܱ����룬����Na2HPO3Ϊ���Σ��ʴ�Ϊ�����Σ�
���ṹ�к���2���ǻ����Ƕ�Ԫ���ᣬ��ö�Ԫ��������������������ӣ�Na2HPO3�Ǹö�Ԫ�����е�Hԭ�Ӳ��ܱ����룬����Na2HPO3Ϊ���Σ��ʴ�Ϊ�����Σ�
(3)�������������ӷ�Ӧ�������ᣬ�����ӻ�ԭΪ�����ʣ���Ӧ��������������������H3PO3�ǻ�ԭ��������ת�Ƶ����غ㣬n(Ag+)=n(H3PO3)��(5-3)�����n(Ag+)��n(H3PO2)=2��1���ʴ�Ϊ��2��1��
(4)��������Һ����̶Ƚ�С�����Ը���Һ�д���c(H2PO3-)��c(H+)=2.5��10-2molL-1��c(H3PO3)=(0.10-2.5��10-2)mol/L�������ƽ�ⳣ��K=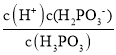 =
=![]() =8.3��10-3 mol/L���ʴ�Ϊ��8.3��10-3 mol/L��
=8.3��10-3 mol/L���ʴ�Ϊ��8.3��10-3 mol/L��
(5)��H3PO3��Һ�еμ�NaOH��Һ�����ԣ���c(H+)=c(OH-)����Һ�д��ڵ���غ㣬���ݵ���غ���c(Na+)=c(H2PO3-)+2c(HPO32-)���ʴ�Ϊ��=��
(6)��̪�ı�ɫ��ΧΪ8-10���Է�̪Ϊָʾ��������Һ����ɫ��Ϊdz��ɫʱ����Һ��pH����8������ͼ����Һ��H2PO3-ת��ΪHPO32-���������ӷ���ʽΪH2PO3-+OH-��HPO32-+H2O���ʴ�Ϊ��H2PO3-+OH-��HPO32-+H2O��