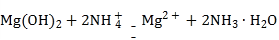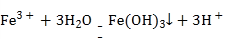题目内容
【题目】氨、尿素[CO(NH2)2]都是氮的重要化合物,在工农业生产中应用广泛。
(1)已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92kJ·mol-1
2NH3(g)ΔH=-92kJ·mol-1
①取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___92.2kJ(填“>”、“=”或“<”),原因是_______________。
②使用催化剂,该反应△H_____(填“变大”“变小”或“不变”)。
③已知:分别破坏1molN≡N键、1molH-H键需要吸收的能量为:946kJ、436kJ,则破坏1molN-H键需要吸收的能量为_____kJ.
(2)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
Ⅰ.2NH3(g)+CO2(g)==NH2CO2NH4(s)△H=﹣159.5kJ/mol
Ⅱ.NH2CO2NH4(s)==CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
Ⅲ.H2O(l)==H2O(g)△H=+44.0kJ/mol
①写出CO2与NH3合成尿素和液态水的热化学反应方程式_______________________。
②化学家正在研究尿素动力燃料电池。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示:
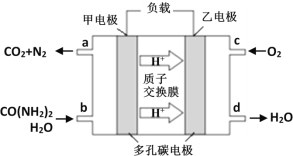
回答下列问题:
电池中的负极为_____(填“甲”或“乙”),甲的电极反应式为_____________,
电池工作时,理论上每净化1mol尿素,消耗O2的体积(标准状况下)约为_____L。
【答案】< 由于该反应是可逆反应,反应物无法全部转化为生成物 不变 391 2NH3(g)+CO2(g)== CO(NH2)2(s)+H2O(l) △H=﹣87.0 kJ/mol 甲 CO(NH2)2+H2O﹣6e﹣== CO2↑+N2↑+6H+ 33.6
【解析】
(1)①合成氨反应为可逆反应,不可能进行到底,故在实际生产中1 mol N2和3 mol H2不可能生成2 mol NH3,放出的热量也必定小于92 kJ;
②催化剂改变反应速率不改变化学平衡及△H;
③ΔH=反应物的键能之和—生成物的键能之和,据此分析作答;
(2)①根据盖斯定律计算;
②该电池CO(NH2)2在负极失电子生成二氧化碳和氮气,氧气在正极反应生成水,电解质溶液中含氢离子,该反应的总方程式为: 2CO(NH2)2+3O2 = 2CO2 + 2N2 + 4H2O,据此分析作答;
(1)①N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1,N2和H2反应生成2 mol NH3时放出的热量为92.2 kJ,是指1 mol氮气和3 mol的氢气完全反应生成2 mol的氨气放出的热量为92.2 kJ,1mol N2和3 molH2放在密闭容器中不可能完全转化为氨气,所以放出热量一定小于92.2 kJ,
2NH3(g) ΔH=-92 kJ·mol-1,N2和H2反应生成2 mol NH3时放出的热量为92.2 kJ,是指1 mol氮气和3 mol的氢气完全反应生成2 mol的氨气放出的热量为92.2 kJ,1mol N2和3 molH2放在密闭容器中不可能完全转化为氨气,所以放出热量一定小于92.2 kJ,
故答案为:<;由于该反应是可逆反应,反应物无法全部转化为生成物;
②催化剂改变反应速率不改变化学平衡,反应热不变,
故答案为:不变;
③已知:分别破坏1 mol N≡N键、1 mol HH键需要吸收的能量为:946 kJ、436 kJ,设破坏1 mol NH键需要吸收的能量为x,根据N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1,焓变=反应物总键能生成物的总键能,即946 kJ/mol+3×436 kJ/mol6x = -92.2 kJ/mol,解得x=391 kJ/mol,即破坏1 mol NH键需要吸收的能量为:391 kJ;
2NH3(g) ΔH=-92 kJ·mol-1,焓变=反应物总键能生成物的总键能,即946 kJ/mol+3×436 kJ/mol6x = -92.2 kJ/mol,解得x=391 kJ/mol,即破坏1 mol NH键需要吸收的能量为:391 kJ;
故答案为:391;
(2)①由Ⅰ. 2NH3(g)+CO2(g)= NH2CO2NH4(s) H = -159.5kJmol-1
Ⅱ.NH2CO2NH4(s)= CO(NH2)2(s)+H2O(g) △H = +116.5kJmol-1
Ⅲ. H2O(l)=H2O(g) △H=+44.0kJmol-1
结合盖斯定律可知,①+②-③得到2NH3(g)+CO2(g)= CO(NH2)2(s)+H2O(l),其△H = 159.5 kJmol1+(+116.5kJmol1)(+44.0kJmol1)=87.0kJmol1,则CO2与NH3合成尿素和液态水的热化学反应方程式为2NH3(g)+CO2(g)== CO(NH2)2(s)+H2O(l) △H=﹣87.0 kJ/mol,
故答案为:2NH3(g)+CO2(g)== CO(NH2)2(s)+H2O(l) △H=﹣87.0 kJ/mol;
②根据图示可知,甲电极上CO(NH2)2反应生成二氧化碳和氮气,N元素化合价升高,失电子,为电源的负极,电解质溶液为酸性,则其电极反应式为:CO(NH2)2+H2O﹣6e﹣== CO2↑+N2↑+6H+,该反应的总方程式为: 2CO(NH2)2+3O2 = 2CO2 + 2N2 + 4H2O,根据关系式2 CO(NH2)2![]() 3O2可知,电池工作时,理论上每净化1mol尿素,消耗O2的体积为1.5 mol
3O2可知,电池工作时,理论上每净化1mol尿素,消耗O2的体积为1.5 mol ![]() 22.4 L/mol = 33.6 L,
22.4 L/mol = 33.6 L,
故答案为:甲;CO(NH2)2+H2O﹣6e﹣== CO2↑+N2↑+6H+;33.6。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】下列离子方程式能用来解释相应实验现象的是
实验现象 | 离子方程式 | |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 |
|
B | 向沸水中滴加饱和氯化铁溶液得到红褐色液体 |
|
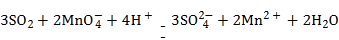
C | 二氧化硫使酸性高锰酸钾溶液褪色 |
|
D | 氧化亚铁溶于稀硝酸 |
|
A. AB. BC. CD. D