题目内容
在一定条件下,在密闭容器中进行可逆反应:A(g)+B(g)?C(g)+D(g),能说明该反应达到化学平衡状态的是( )
| A、正反应和逆反应的速率相等 | B、正反应速率逐渐减小,最后为零 | C、反应停止,A、B、C、D的浓度相等 | D、A、B、C、D四种物质在密闭容器中共存 |
分析:可逆反应A(g)+B(g)?C(g)+D(g )达到化学平衡状态,一定满足正逆反应速率相等,反应体系中各组分的浓度不再变化;注意该反应中气体的体积不变,达到平衡状态反应速率不是等于0,据此进行判断.
解答:解:A、正逆反应速率相等,各组分的浓度不再变化,一定达到了化学平衡状态,故A正确;
B、达到平衡状态,正逆反应速率相等,各组分的浓度不再变化,最后反应速率不是等于0,故B错误;
C、达到平衡状态,反应继续进行,正逆反应速率相等,各组分的浓度不再变化,各组分的浓度不一定相等,故C错误;
D、任何可逆反应中,反应物和生成物一定会共存,所以A、B、C、D四种物质在密闭容器中共存,无法判断是否达到平衡状态,故D错误;
故选:A.
B、达到平衡状态,正逆反应速率相等,各组分的浓度不再变化,最后反应速率不是等于0,故B错误;
C、达到平衡状态,反应继续进行,正逆反应速率相等,各组分的浓度不再变化,各组分的浓度不一定相等,故C错误;
D、任何可逆反应中,反应物和生成物一定会共存,所以A、B、C、D四种物质在密闭容器中共存,无法判断是否达到平衡状态,故D错误;
故选:A.
点评:本题考查化学平衡状态的判断,题目难度不大,注意达到化学平衡状态,正逆反应速率相等,不是反应速率为0,反应没有停止.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
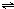 ClO(g)+3H2(g)△H>0.
ClO(g)+3H2(g)△H>0.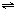 CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
 C (g) + D(g),能说明该反应达到化学平衡状态的是
C (g) + D(g),能说明该反应达到化学平衡状态的是