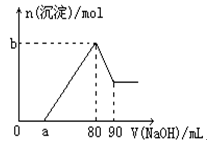
题目内容
某一定量的铁与稀盐酸反应,标准状况下生成了4.48L氢气,若所用盐酸的浓度为0.5mol/L,则至少需要盐酸的体积为多少升?
设需盐酸体积为V,则
Fe + 2HCl = FeCl2 + H2↑
2mol 22.4L
0.5mol/L×V 4.48L
所以 2mol ÷ (0.5mol/L×V ) =22.4L ÷ 4.48L
解得V = 0.8L
Fe + 2HCl = FeCl2 + H2↑
2mol 22.4L
0.5mol/L×V 4.48L
所以 2mol ÷ (0.5mol/L×V ) =22.4L ÷ 4.48L
解得V = 0.8L
考查根据方程式进行的有关计算。

练习册系列答案
相关题目
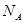 表示阿伏加德罗常数,则下列叙述正确的是
表示阿伏加德罗常数,则下列叙述正确的是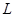 四氯化碳含有
四氯化碳含有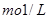 的醋酸溶液中含有
的醋酸溶液中含有 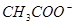 离子
离子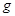 甲烷含有10
甲烷含有10