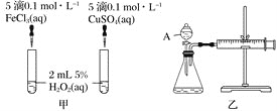
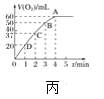
题目内容
【题目】工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
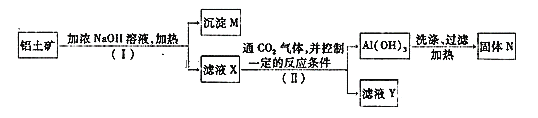
(1)I和Ⅱ步骤中分离溶液和沉淀的操作是:_____________。
(2)沉淀M中除含有泥沙外,一定还含有_________(填化学式),生成固体N反应的化学方程式为_________。
(3)滤液X中,含铝元素的溶质的化学式为___________,它属于__________(填“酸”、“碱”或“盐”)类物质。
(4)实验室里常往AlCl3溶液中加入___________(填“氨水”或“NaOH溶液”)来制取Al(OH)3,该反应的离子方程式为_________________。
【答案】过滤 Fe2O3 2Al(OH)3![]() Al2O3+3H2O NaAlO2 盐 氨水 Al3++3NH3·H2O=Al(OH)3↓+3NH4+
Al2O3+3H2O NaAlO2 盐 氨水 Al3++3NH3·H2O=Al(OH)3↓+3NH4+
【解析】
(1)实现固体和液体的分离用过滤的方法;
(2)根据流程图来确定发生的反应以及各种物质;
(3)根据流程图来确定发生的反应以及各种物质;
(4)氢氧化铝不溶于弱碱,AlCl3溶液中加入氨水可以制取氢氧化铝。
Al2O3、Fe2O3、SiO2中加入浓的氢氧化钠溶液时,其中的Al2O3、SiO2会与之发生反应分别生成NaAlO2和Na2SiO3的水溶液,即为滤液X,所以沉淀M主要是Fe2O3,NaAlO2和过量的CO2反应生成Al(OH)3沉淀和NaHCO3,Na2SiO3和过量的CO2反应生成NaHCO3和H2SiO3沉淀。
(1)分离溶液和沉淀的操作是过滤;
(2)沉淀M除含有泥沙外,主要是Fe2O3,Al(OH)3受热易分解生成Al2O3和H2O,所以固体N是Al2O3。Al(OH)3受热易分解的化学方程式为:2Al(OH)3![]() Al2O3+3H2O;
Al2O3+3H2O;
(3)滤液X中,含铝元素的溶质是偏铝酸钠,化学式为NaAlO2,由金属阳离子Na+和酸根离子AlO2-组成,因此该物质属于盐类;
(4)Al(OH)3是两性氢氧化物,可以与强酸、强碱发生反应,所以在实验室里常往AlCl3溶液中加入氨水可以制取氢氧化铝,氢氧化铝不溶于弱碱,反应原理为Al3++3NH3·H2O=Al(OH)3↓+3NH4+。

 名校课堂系列答案
名校课堂系列答案