题目内容
合成氨对化学工业和国防工业具有重要意义.(1)向合成塔中按1:4的物质的量之比充入N2、H2进行氨的合成,图A为TC时平衡混合物中氨气的体积分数与压强(P)的关系图.

①写出工业上合成氨的化学方程式 .
②图A中氨气的体积分数为15.00%时,H2的转化率= .
③图B中T=500°C,温度为450C对应的曲线是 (选填字母“a“或“b”),选择的理由是
④由图象知,增大压强可提高原料的利用率,从生产实际考虑增大压强需解决的问题是 (写出一条即可).
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:
CH4(g)+H2O
 CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
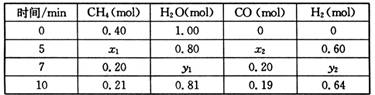
CO(g)+3H2(g);△H=+QkJ/mol(Q>0)(3)一定温度下,在2L容器中发生上述反应,各物质的物质的量变化如下表
| 时间/min | CH4(mol) | H20( mol) | CO (mol) | H2 (mol) |
| 0.40 | 1.00 | |||
| 5 | X1 | X2 | X3 | 0.60 |
| 7 | Y1 | Y2 | 0.20 | Y3 |
| 10 | 0.21 | 0.81 | 0.19 | 0.62 |
前5min平均反应速率v(CH4)= .
②反应在7~10min之间,CO的物质的量减少的原因可能是 (填字母).
a?减少CH4 b?降低温度c?增大压强d?充入H2
③若保持温度不变,向1L容器中起始充入0.15mol CH4.0.45mol H2O. mol CO、 mol H2,达到平衡时CH4的体积百分含量与第一次投料相同.
【答案】分析:(1)①工业上利用氮气和氢气来合成氨;
②根据三行计算来确定物质的转化率;
③降低温度,化学平衡向放热反应方向移动;
④从生产实际考虑增大压强对设备的损耗情况;
(2)①化学平衡状态时各组分的浓度不再随时间的改变而改变,根据v=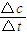 来计算反应的速率;
来计算反应的速率;
②根据影响化学平衡移动的因素来分析;
③根据等效平衡知识来回答.
解答:解:(1)①工业上利用氮气和氢气来合成氨,原理方程式为:N2+3H2 2NH3,故答案为:N2+3H2
2NH3,故答案为:N2+3H2 2NH3;
2NH3;
②设N2的转化率为x,则N2+3H2 2NH3
2NH3
初始物质的量:1 4 0
变化的物质的量:x 3x 2x
平衡时的物质的量:1-x 4-3x 2x
氨气的体积分数为15.00%时,则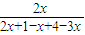 =15%
=15%
解得x=0.33(mol),所以氢气的转化率=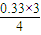 ×100%≈24.45%,故答案为:24.45%;
×100%≈24.45%,故答案为:24.45%;
③对于反应N2+3H2 2NH3,当温度降低时,化学平衡向放热反应方向移动,所以氨气的体积分数增大,对应的曲线是b,
2NH3,当温度降低时,化学平衡向放热反应方向移动,所以氨气的体积分数增大,对应的曲线是b,
故答案为:b;合成氨的正反应是放热反应,根据勒夏特列原理,其他条件不变,降低温度,化学平衡向放热反应方向移动;
④增大压强可提高原料的利用率,但是设备的耐压程度是有限的,从生产实际考虑增大压强可以研制耐压设备或增大压强的动力、材料的强度等,
故答案为:研制耐压设备(或增大压强的动力、材料的强度等其他合理答案);
(2)①根据一氧化碳和氢气的物质的量的变化情况可以判断,5?7min之间反应是处于平衡状态,前5min平均反应速率v(CH4)=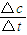 =
=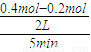 =0.02mol?min-1,
=0.02mol?min-1,
故答案为:是;0.02mol?min-1;
②反应在7~10min之间,CO的物质的量减少,加入氢气能让平衡逆向移动,减少一氧化碳的浓度,故答案为:d;
③若保持温度不变,向1L容器中起始充入0.15molCH4、0.45molH2O,再充入0.05molCO、0.15molH2相当于是0.05mol的甲烷和0.05mol的水,即充入甲烷是0.2mol,水是0.5mol,和初始投料0.4mol的甲烷和1.0mol的水是等效的,达到平衡时CH4的体积百分含量相同,故答案为:0.05;0.15.
点评:本题是一道化学平衡知识的综合题,考查学生分析和解决问题的能力,题目难度大.
②根据三行计算来确定物质的转化率;
③降低温度,化学平衡向放热反应方向移动;
④从生产实际考虑增大压强对设备的损耗情况;
(2)①化学平衡状态时各组分的浓度不再随时间的改变而改变,根据v=
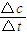 来计算反应的速率;
来计算反应的速率;②根据影响化学平衡移动的因素来分析;
③根据等效平衡知识来回答.
解答:解:(1)①工业上利用氮气和氢气来合成氨,原理方程式为:N2+3H2
 2NH3,故答案为:N2+3H2
2NH3,故答案为:N2+3H2 2NH3;
2NH3;②设N2的转化率为x,则N2+3H2
 2NH3
2NH3初始物质的量:1 4 0
变化的物质的量:x 3x 2x
平衡时的物质的量:1-x 4-3x 2x
氨气的体积分数为15.00%时,则
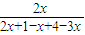 =15%
=15%解得x=0.33(mol),所以氢气的转化率=
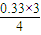 ×100%≈24.45%,故答案为:24.45%;
×100%≈24.45%,故答案为:24.45%;③对于反应N2+3H2
 2NH3,当温度降低时,化学平衡向放热反应方向移动,所以氨气的体积分数增大,对应的曲线是b,
2NH3,当温度降低时,化学平衡向放热反应方向移动,所以氨气的体积分数增大,对应的曲线是b,故答案为:b;合成氨的正反应是放热反应,根据勒夏特列原理,其他条件不变,降低温度,化学平衡向放热反应方向移动;
④增大压强可提高原料的利用率,但是设备的耐压程度是有限的,从生产实际考虑增大压强可以研制耐压设备或增大压强的动力、材料的强度等,
故答案为:研制耐压设备(或增大压强的动力、材料的强度等其他合理答案);
(2)①根据一氧化碳和氢气的物质的量的变化情况可以判断,5?7min之间反应是处于平衡状态,前5min平均反应速率v(CH4)=
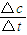 =
=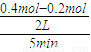 =0.02mol?min-1,
=0.02mol?min-1,故答案为:是;0.02mol?min-1;
②反应在7~10min之间,CO的物质的量减少,加入氢气能让平衡逆向移动,减少一氧化碳的浓度,故答案为:d;
③若保持温度不变,向1L容器中起始充入0.15molCH4、0.45molH2O,再充入0.05molCO、0.15molH2相当于是0.05mol的甲烷和0.05mol的水,即充入甲烷是0.2mol,水是0.5mol,和初始投料0.4mol的甲烷和1.0mol的水是等效的,达到平衡时CH4的体积百分含量相同,故答案为:0.05;0.15.
点评:本题是一道化学平衡知识的综合题,考查学生分析和解决问题的能力,题目难度大.

练习册系列答案
相关题目

 CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
 2NH3(g);△H=-92.4kJ/mol
2NH3(g);△H=-92.4kJ/mol CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表: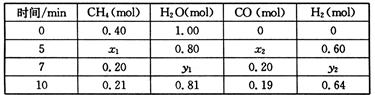
 CO(g)+3H2(g)
△H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g)
△H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表: