题目内容
(14分)合成氨对化学工业和国防工业具有重要意义。
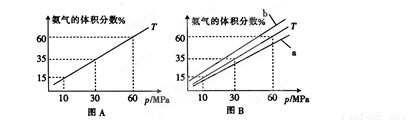
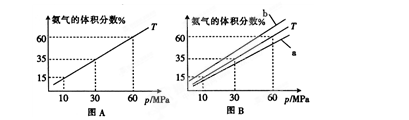
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。
①图A中氨气的体积分数为15%时,H2的转化率为 。
②图B中T=450℃,则温度为500℃时对应的曲线是 (填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为
CH4(g)+H2O(g)  CO(g)+3H2(g)
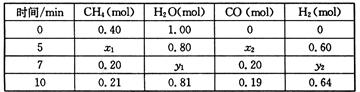
△H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g)
△H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
①分析表中数据,判断5 min时反应是否处于平衡状态? (填“是”或“否”),前5 min反应的平均反应速率v(CH4)= 。
②该温度下,上述反应的平衡常数K= 。
③反应在7~10 min内,CO的物质的量减少的原因可能是 (填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④若第7分钟时将容器压缩至1L,请在下列坐标系中画出从第7分钟到第11分钟建立新平衡时甲烷浓度随时间的变化曲线。
a
(1) ①24.46% ②a (2) ①是;0.02mol·L-1·min-1;②0.0675;③d
④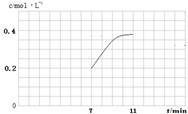
【解析】
试题分析:(1)N2(g) +3H2(g) 2NH3(g)
2NH3(g)
起始 a 4a
反应 x 3x 2x
平衡 a-x 4a-3x 2x
氨气的体积分数为 ,解得
,解得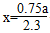 ;氢气转化率为
;氢气转化率为 =24.46%;
=24.46%;
温度升高,平衡逆向移动,体积分数减小,故曲线为a。
(2)①5min时x1=x2=0.20mol,7min时CH4的量没有改变,说明5min时已达到平衡状态;v(CH4)=0.2mol÷2L÷5min=0.02mol/(L·min)
②K= =0.0675;
=0.0675;
③7~10 min,氢气浓度增大,其他浓度均减小,平衡逆向移动,故为充入氢气;
④压缩容器体积,等效于增大压强,平衡向左移动,甲烷浓度增大,但CO和H2不可能完全转化成甲烷和水,0.2molCO和水最多生成甲烷0.2mol,所以平衡时甲烷浓度小于0.4mol/L。
考点:化学反应速率 化学平衡。
点评:本题最后一问若利用平衡常数计算相当繁琐,可利用极端假设法思考出最终甲烷浓度最大值然后作出示意图。

 CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表: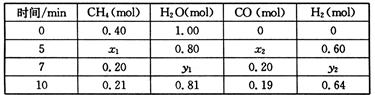
 CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表: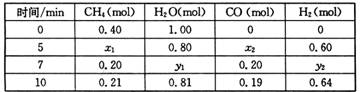
 CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表: