题目内容
(2010?宝鸡三模)合成氨对化学工业和国防工业具有重要意义,寻找方便廉价的合成氨方法自然成为化学科技工作者的研究方向.
请回答下列有关合成氨反应的有关问题:
(1)在一定温度和催化剂下,将3.2mol H2和1.2molN2混合于一个容积为2L的密闭容器中发生反应,在2min末时反应恰好达平衡,此时生成了0.8mol NH3.则在2min内以H2表示的反应速率为
(2)在(1)中平衡时,若要想通过改变反应条件使平衡向正反应方向移动且平衡常数不变,可改变的反应条件为
(3)若已知:N2(g)+O2(g)═2NO(g);△H=180.5kJ/mol
4NH3(g)+5O2(g)═4NO(g)+6H2O(g);△H=一905kJ/mol
2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol
请写出合成氨反应的热化学方程式
(4)Marnellos和Stoukides发明了电化学制备氨气的方法,该方法用SCY陶瓷将负极和正极隔开,SCY陶瓷具有高质子导电性,其作用是传递H+,这种方法实现了高温常压下高转化率的电化学合成氨.已知负极的电极反应为H2一2e-═2H+,则正极发生的电极反应为
请回答下列有关合成氨反应的有关问题:
(1)在一定温度和催化剂下,将3.2mol H2和1.2molN2混合于一个容积为2L的密闭容器中发生反应,在2min末时反应恰好达平衡,此时生成了0.8mol NH3.则在2min内以H2表示的反应速率为
0.3mol/(L?min)
0.3mol/(L?min)
;N2此时的转化率为33.3%
33.3%
,该条件下的平衡常数为0.4mol-2?L2
0.4mol-2?L2
.(2)在(1)中平衡时,若要想通过改变反应条件使平衡向正反应方向移动且平衡常数不变,可改变的反应条件为
增大压强(或增大反应物的浓度,或将氨气从混合体系中分离出去)
增大压强(或增大反应物的浓度,或将氨气从混合体系中分离出去)
(任填一种).(3)若已知:N2(g)+O2(g)═2NO(g);△H=180.5kJ/mol
4NH3(g)+5O2(g)═4NO(g)+6H2O(g);△H=一905kJ/mol
2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol
请写出合成氨反应的热化学方程式
N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ/mol
2NH3(g);△H=-92.4kJ/mol
 2NH3(g);△H=-92.4kJ/mol
2NH3(g);△H=-92.4kJ/molN2(g)+3H2(g) 2NH3(g);△H=-92.4kJ/mol
2NH3(g);△H=-92.4kJ/mol
. 2NH3(g);△H=-92.4kJ/mol
2NH3(g);△H=-92.4kJ/mol(4)Marnellos和Stoukides发明了电化学制备氨气的方法,该方法用SCY陶瓷将负极和正极隔开,SCY陶瓷具有高质子导电性,其作用是传递H+,这种方法实现了高温常压下高转化率的电化学合成氨.已知负极的电极反应为H2一2e-═2H+,则正极发生的电极反应为
N2+6H++6e-═2NH3
N2+6H++6e-═2NH3
.分析:(1)利用三段式解题法,求各组分平衡时的物质的量、转化的物质的量,代入v(H2)=
,α(N2)=
×100%,平衡常数k=
计算;
(2)平衡常数不变,不改变温度,根据其它影响因素解答;
(3)根据盖斯定律,利用热化学方程式乘以适当数值相叠加,构造出目标热化学方程式;
(4)总反应式减去负极电极反应式,即为正极电极反应式.
| △c(H2) |
| △t |
| △n(N2) |
| n(N2)开始 |
| [c(NH3)]2 |
| c(N2)?[c(H2)]3 |
(2)平衡常数不变,不改变温度,根据其它影响因素解答;
(3)根据盖斯定律,利用热化学方程式乘以适当数值相叠加,构造出目标热化学方程式;
(4)总反应式减去负极电极反应式,即为正极电极反应式.
解答:解:(1)利用三段式解题法,求各组分平衡时的物质的量、转化的物质的量.
2min末时反应恰好达平衡,此时生成了0.8mol NH3.
N2(g)+3H2(g) 2NH3(g);
2NH3(g);
开始(mol):1.2 3.2 0
变化(mol):0.4 1.2 0.8
平衡(mol):0.8 2 0.8
所以v(H2)=
=
=
=0.3mol/(L?min),
α(N2)=
×100%=
×100%=33.3%,
平衡常数k=
=
=0.4mol-2?L2.
故答案为:0.3mol/(L?min);33.3%;0.4mol-2?L2;
(2)平衡常数不变,不改变温度.增大反应物浓度或降低生成物的浓度,平衡向正反应移动.故可以增大反应物的浓度,或将氨气从混合体系中分离出去.反应前后气体体积减小,可以增大压强,平衡向正反应移动.
故答案为:增大压强(或增大反应物的浓度,或将氨气从混合体系中分离出去);
(3)已知:①N2(g)+O2(g)═2NO(g);△H=180.5kJ/mol
②4NH3(g)+5O2(g)═4NO(g)+6H2O(g);△H=一905kJ/mol
③2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol
①+③×
-②×
得:N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ/mol,
2NH3(g);△H=-92.4kJ/mol,
故答案为:N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ/mol;
2NH3(g);△H=-92.4kJ/mol;
(4)总反应式为N2+3H2=2NH3;
负极的电极反应为3H2-6e-═6H+;
总反应式减去负极电极反应式,即为正极电极反应式,
所以正极电极反应式为:N2+6H++6e-═2NH3,故答案为:N2+6H++6e-═2NH3.
2min末时反应恰好达平衡,此时生成了0.8mol NH3.
N2(g)+3H2(g)
 2NH3(g);
2NH3(g);开始(mol):1.2 3.2 0
变化(mol):0.4 1.2 0.8
平衡(mol):0.8 2 0.8
所以v(H2)=
| △c(H2) |
| △t |
| ||
| △t |
| ||
| 2min |
α(N2)=
| △n(N2) |
| n(N2)开始 |
| 0.4mol |
| 1.2mol |
平衡常数k=
| [c(NH3)]2 |
| c(N2)?[c(H2)]3 |
[
| ||||
|
故答案为:0.3mol/(L?min);33.3%;0.4mol-2?L2;
(2)平衡常数不变,不改变温度.增大反应物浓度或降低生成物的浓度,平衡向正反应移动.故可以增大反应物的浓度,或将氨气从混合体系中分离出去.反应前后气体体积减小,可以增大压强,平衡向正反应移动.
故答案为:增大压强(或增大反应物的浓度,或将氨气从混合体系中分离出去);
(3)已知:①N2(g)+O2(g)═2NO(g);△H=180.5kJ/mol
②4NH3(g)+5O2(g)═4NO(g)+6H2O(g);△H=一905kJ/mol
③2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol
①+③×
| 3 |
| 2 |
| 1 |
| 2 |
 2NH3(g);△H=-92.4kJ/mol,
2NH3(g);△H=-92.4kJ/mol,故答案为:N2(g)+3H2(g)
 2NH3(g);△H=-92.4kJ/mol;
2NH3(g);△H=-92.4kJ/mol;(4)总反应式为N2+3H2=2NH3;
负极的电极反应为3H2-6e-═6H+;
总反应式减去负极电极反应式,即为正极电极反应式,
所以正极电极反应式为:N2+6H++6e-═2NH3,故答案为:N2+6H++6e-═2NH3.
点评:本题考查化学平衡计算、平衡常数、热化学方程式、原电池等,综合较大,难度中等,注意两电极反应式相加得总反应式时,两电极得失电子数应相等.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
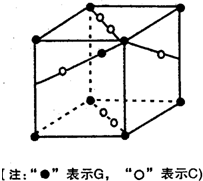 (2010?宝鸡三模)[化学-选修3物质结构与性质]
(2010?宝鸡三模)[化学-选修3物质结构与性质]