题目内容
甲、乙、丙、丁为四种主族元素,已知甲与乙、丙、丁三种元素相邻,甲、乙的原子序数之和等于丙的原子序数,四种元素原子的最外层电子数之和为20。下列判断中正确的
是( )
| A.原子半径:丙>乙>甲 |
| B.最外层电子数:丙=丁 |
| C.气态氢化物的稳定性:甲>丙 |
| D.最高价氧化物对应的水化物的酸性:丁>甲 |
C
解析

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
原子序数依次增大的短周期主族元素W、X、Y、Z和M中,W的最外层电子数为其周期数的二倍;X和Z的A2B型氢化物均为V形分子,Y的+1价离子比M的-1价离子少8个电子。根据以上叙述,下列说法中正确的是
| A.上述四种元素的原子半径大小为W<X<Y<Z<M |
| B.由这些元素形成的三原子分子中,空间结构为直线形的有WX2,WZ2,ZX2 |
| C.元素W与氢形成的原子个数比为1﹕1的化合物有很多种 |
| D.X与Y可形成含有非极性共价键的共价化合物 |
下列有关结构和性质的说法中不正确的是 ( )
| A.元素周期表中从ⅢB族到ⅡB族十个纵行的元素都是金属元素 |
| B.碱性:NaOH > NH3·H2O ,所以元素的金属性:Na > N |
| C.同周期第ⅡA族与第ⅢA族的元素原子序数之差不一定为1 |
| D.第ⅦA族元素从上到下,其氢化物的稳定性逐渐减弱 |
下列说法中正确的是( )
| A.元素周期表是按相对原子质量逐渐增大的顺序从左到右排列的 |
| B.最外层电子数相同的元素一定属于同一族 |
| C.非金属元素的最外层电子数都大于等于4 |
| D.同周期元素的电子层数相同 |
元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是( )
| A.主族元素原子的最外层电子数等于元素的最高正化合价 |
| B.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| C.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 |
| D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
据报道,2012年俄罗斯科学家再次合成117号元素。本次实验生成了6个新原子,其中5个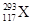 ,1个
,1个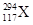 。下列关于
。下列关于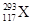 和
和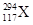 的说法不正确的是( )
的说法不正确的是( )
| A.是两种核素 | B.互为同位素 | C.中子数分别为176和177 | D.电子数相差1 |
元素X形成的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径,X元素为( )
| A.Al | B.P | C.Ar | D.K |
下列有关原子结构及元素周期律的叙述正确的是 ( )。
| A.同主族元素的原子最外层电子数相同,化学性质也相同 |
| B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
| C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 |
| D.同主族元素从上到下,单质的熔点逐渐降低 |
下列说法中错误的是( )。
| A.SO2、SO3都是极性分子 |
| B.在NH4+和[Cu(NH3)4]2+中都存在配位键 |
| C.元素电负性越大的原子,吸引电子的能力越弱 |
| D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |