题目内容
元素X形成的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径,X元素为( )
| A.Al | B.P | C.Ar | D.K |
D
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,常见金属元素Z的一种核素的质量数为28,中子数比质子数多2。下列说法中正确的是
| A.用“百度”搜索知,Y、Z形成的化合物“室温下强度高,……。导热性好,热膨胀系数小,是良好的耐热冲击材料。”由此可推测该化合物属于离子晶体 |
| B.化合物YW3水解产物之一具有强氧化性,由此可知Y在该化合物中的化合价为+3 |
| C.由非金属元素组成的化合物YX5是一种是否存在尚待确证的化合物,假如存在,该物质与水反应必然生成气体X2,同时得到一种弱碱溶液 |
| D.因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取单质Z |
下列说法中不正确的是( )
| A.已知原子的核电荷数,可以推知该原子的周期序数 |
| B.原子的电子层数等于该原子的周期序数,前20号元素中,阳离子的电子层数等于对应原子的周期序数减去1,阴离子的电子层数等于对应原子的周期序数 |
| C.知道原子的周期序数,就能确定该元素在周期表中的位置 |
| D.知道原子的周期序数,还不能确定该元素在周期表中的位置 |
甲、乙、丙、丁为四种主族元素,已知甲与乙、丙、丁三种元素相邻,甲、乙的原子序数之和等于丙的原子序数,四种元素原子的最外层电子数之和为20。下列判断中正确的
是( )
| A.原子半径:丙>乙>甲 |
| B.最外层电子数:丙=丁 |
| C.气态氢化物的稳定性:甲>丙 |
| D.最高价氧化物对应的水化物的酸性:丁>甲 |
元素的原子结构决定其性质和在周期表中的位置,下列有关结构和性质的说法中,正确的是( )
| A.形成离子键的阴阳离子间只存在静电吸引力 |
| B.元素周期表中,第三周期最右端的元素原子得电子能力最强 |
| C.最易失去的电子能量最高 |
| D.目前使用的元素周期表中最长的周期含有36种元素 |
下表是元素周期表的一部分,有关说法正确的是( )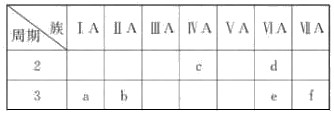
| A.e的氢化物比d的氢化物稳定 |
| B.a、b、e三种元素的原子半径:e>b>a |
| C.6种元素中,c元素单质的化学性质最活泼 |
| D.c、e、f的最高价氧化物对应的水化物的酸性依次增强 |
13153I是常规核裂变产物之一,可以通过测定大气或水中13153I的含量变化来检测核电站是否发生放射性物质泄漏。下列有关13153I的叙述中错误的是( )
| A.13153I的化学性质与12753I相同 |
| B.13153I的原子序数为53 |
| C.13153I的原子核外电子数为78 |
| D.13153I的原子核内中子数多于质子数 |