��Ŀ����
����Ŀ��Ԫ����~�������ڱ��е�λ�������ʾ���Իش��������⡣
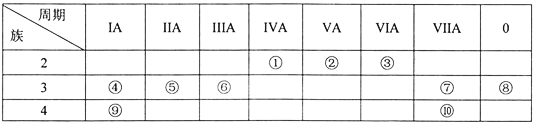
��1������10��Ԫ���У���ѧ��������õ���___(��Ԫ�ط��ţ���ͬ)����ˮ��Ӧ��ҵĽ���Ԫ����___________��
��2��Ԫ��������̬�⻯��ķ���ʽ��_____������10��Ԫ���У�������������Ӧˮ�����������ǿ��������_______(�ѧʽ)��
��3��Ԫ���������γɵij������������Ļ�����ĵ���ʽ_________��
��4���٢ڢ�Ԫ�ص�ԭ�Ӱ뾶��С�����˳��Ϊ______(��Ԫ�ط��ű�ʾ)��
����һ����ѧ����ʽ(�����ӷ���ʽ)˵��Ԫ���������ǽ����Ե�ǿ����_____��
��5����������Ԫ�ص�����������Ӧ��ˮ�������Ӧ�����ӷ���ʽ��____________��
���𰸡� Ar K NH3 HClO4 ![]() N<C<Mg 2HBr+Cl2=2HC1+Br2 Al(OH)3+OH-=AlO2-+2H2O
N<C<Mg 2HBr+Cl2=2HC1+Br2 Al(OH)3+OH-=AlO2-+2H2O
��������Ԫ����~�������ڱ��е�λ�������ʾ,��ΪC,��ΪN,��ΪO,��ΪNa,��ΪMg,��ΪAl,��ΪCl,��ΪAr,��ΪK,��ΪBr��
(1)0��Ԫ�ػ�ѧ�����ȶ�,����10��Ԫ����,��ѧ��������õ���Ar��������ǿ����ˮ��Ӧ������ͬ���ڽ����Լ�����ͬ�����������ǿ������ˮ��Ӧ��ҵĽ���Ԫ����K����ȷ����Ar�� K��
(2)Ԫ��������̬�⻯��Ϊ����,����ʽ��NH3 ,�ǽ�������ǿ�ķǽ����γ�����������Ӧˮ�����������ǿ��ͬ���ڴ����ҷǽ�������ǿ��ͬ������ϵ��·ǽ����Լ���������10��Ԫ����������������Ӧˮ�����������ǿ��������HClO4 ����ȷ��: NH3��HClO4��
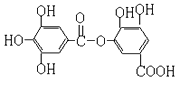
(3) Ԫ�آ�����γɵij������������Ļ�����Ϊ�������ƣ�Ϊ���ӻ���������ʽ��![]() ����ȷ�𰸣�
����ȷ�𰸣�![]() ��
��
��4��ԭ�Ӱ뾶�Ƚ��ǵ��Ӳ���Խ��뾶Խ��,���Ӳ�����ͬ,�˵����Խ��뾶ԽС,�٢ڢ�Ԫ�ص�ԭ�Ӱ뾶��С�����˳��Ϊ:N��C��Mg��ͬһ���������ϵ������ǽ����Լ�������˷ǽ�����Cl> Br�����ʵ���������Cl2> Br2�����������û��嵥�������ԴﵽĿ����������ͨ�뵽��������Һ�������ɵ���������ѧ����ʽΪ2HBr+Cl2=2HC1+Br2����ȷ�𰸣�N<C<Mg �� 2HBr+Cl2=2HC1+Br2��
��5����Ԫ�ص�����������Ӧ��ˮ����ΪNaOH����Ԫ���γɵ�����������Ӧ��ˮ����Ϊ����������������������������������������Һ����ƫ�����ƺ�ˮ����Ӧ�����ӷ���ʽΪ: Al(OH)3+OH-=AlO2-+2H2O����ȷ����Al(OH)3+OH-=AlO2-+2H2O��