题目内容
【题目】(1)微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-。根据上述反应式,完成下列题目。

(a)下列叙述正确的是________。
A.在使用过程中,电解质溶液的pH增大
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
(b)写出电池的总反应式:___________________。
(2)某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
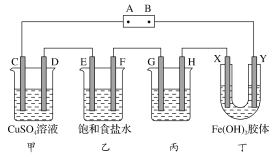
(a)电源A极的名称是________。
(b)甲装置中电解反应的总化学方程式:___________
(c)如果收集乙装置中产生的气体,两种气体的体积比是________。
(d)欲用丙装置给铜镀银,G应该是________(填“铜”或“银”)。
(e)装置丁中的现象是_________。
【答案】C Zn+Ag2O=2Ag+ZnO 正极 2CuSO4+2H2O![]() 2Cu+O2↑+H2SO4 1∶1 银 Y极附近红褐色变深
2Cu+O2↑+H2SO4 1∶1 银 Y极附近红褐色变深
【解析】
(1)原电池是将化学能转化为电能的装置,原电池中负极发生氧化反应,正极发生还原反应,将正负电极上电极反应式相加即得电池总反应式,据此分析解答;
(2)将电源接通后,向乙中滴入酚酞试液,在F极附近显红色,说明F极生成OH-,F为阴极,则可知A为正极,B为负极,C、E、G、X为阳极,D、F、H、Y为阴极,据此分析解答。
(1)(a)A.负极发生氧化反应,电极反应式为Zn+2OH--2e-=ZnO+H2O、正极发生还原反应,电极反应式为 Ag2O+H2O+2e-=2Ag+2OH-,所以电池反应式为Zn+Ag2O=2Ag+ZnO,所以氢氧化钾的浓度不变,溶液的pH不变,故A错误;B.由电极反应式可知,Zn的化合价由0价升高到+2价,被氧化,为原电池的负极,则正极为Ag2O,原电池中电子从负极流向正极,即从锌经导线流向Ag2O,故B错误;C.根据B的分析,Zn是负极,Ag2O是正极,故C正确;D.由电极反应式可知,Zn的化合价由0价升高到+2价,为原电池的负极,发生氧化反应,Ag2O是正极发生还原反应,故D错误;故答案为:C;
(b)负极电极反应式为Zn+2OH--2e-=ZnO+H2O、正极电极反应式为 Ag2O+H2O+2e-=2Ag+2OH-,所以电池反应为Zn+Ag2O=2Ag+ZnO,故答案为:Zn+Ag2O=2Ag+ZnO;
(2)将电源接通后,向乙中滴入酚酞试液,在F极附近显红色,说明F极生成OH-,F为阴极,则电源的A为正极,B为负极,C、E、G、X为阳极,D、F、H、Y为阴极。
(a)由上述分析可知,A是电源的正极,B是电源的负极,故答案为:正极;
(b)甲装置为电解硫酸铜溶液,电解硫酸铜溶液生成硫酸、铜和氧气,电解的方程式为2CuSO4+2H2O![]() 2Cu+O2↑+H2SO4,故答案为:2CuSO4+2H2O
2Cu+O2↑+H2SO4,故答案为:2CuSO4+2H2O![]() 2Cu+O2↑+H2SO4;
2Cu+O2↑+H2SO4;
(c)装置乙为电解饱和食盐水,电解原理为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,产生的氢气和氯气体积比为1∶1,故答案为:1∶1;
2NaOH+H2↑+Cl2↑,产生的氢气和氯气体积比为1∶1,故答案为:1∶1;
(d)给铜镀银,阳极应为银,阴极为铜,即G为银极,故答案为:银;
(e)氢氧化铁胶体粒子带正电荷,在直流电的作用下,胶体粒子会向阴极即Y极移动,所以Y极附近红褐色变深,故答案为:Y极附近红褐色变深。