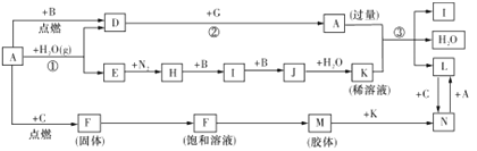
题目内容
【题目】主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍.X、Y和Z分属不同的周期,它们的原子序数之和是W原子序数的5倍.在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高.请回答下列问题:
(1)W元素原子的L层电子排布式为 , W3分子的空间构型为 .
(2)X单质与水发生主要反应的化学方程式为 .
(3)化合物M的化学式为 , 其晶体结构与NaCl相同,而熔点高于NaCl.M熔点较高的原因是 . 将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯.在碳酸二甲酯分子中,碳原子采用的杂化方式有 , O﹣C﹣O的键角约为 .
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X:Y:Z= .
(5)含有元素Z的盐的焰色反应为色.许多金属盐都可以发生焰色反应,其原因是 .
【答案】
(1)2s22p4;V形
(2)2F2+2H2O═4HF+O2
(3)MgO;MgO的晶格能大于NaCl的晶格能;sp2和sp3;120°
(4)3:1:1
(5)紫;灼烧时电子从基态到激发态,当从激发态回到基态时放出能量以光的形式放出,从而出现不同的颜色
【解析】解:主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍,W原子只能有2个电子层,最外层电子数为6,则W为O元素.X、Y和Z分属不同的周期,它们的原子序数之和是W原子序数的5倍,即三元素原子序数之和为40,X若为第三周期元素,X、Y、Z的原子序数之和大于W原子序数的5倍,所以可以断定X也在第二周期,故X为F元素,则Y、Z原子序数之和=40﹣9=31,平均原子序数为15.5,可以推断Y处于第三周期、Z处于第四周期,Z的原子序数大于18,若Y为Na元素,则Z为Ca元素,若Y为Mg元素,则Z为K元素,X的原子序数再增大,不符合题意,由于元素W与Y形成的化合物M的熔点最高,故Y为Mg元素,Z为K元素,化合物M为MgO.(1)W为氧元素,根据核外电子排布规律,O原子的L层电子排布式为2s22p4 , O3分子中中心氧原子价层电子对数=2+ ![]() =3、含有1对孤电子对,故O3空间构型为V形, 所以答案是:2s22p4;V形;(2)X为F元素,对应的单质具有强氧化性,可与水反应生成HF和氧气,反应的方程式为:2F2+2H2O═4HF+O2 ,
=3、含有1对孤电子对,故O3空间构型为V形, 所以答案是:2s22p4;V形;(2)X为F元素,对应的单质具有强氧化性,可与水反应生成HF和氧气,反应的方程式为:2F2+2H2O═4HF+O2 ,
所以答案是:2F2+2H2O═4HF+O2;(3)由上述分析可知,M为MgO,其晶体结构与NaCl相同,而熔点高于NaCl,由于MgO晶体中离子的电荷多,晶格能大,故MgO熔点较高;由碳酸的结构可知碳酸二甲酯的结构为 ![]() ,﹣CH3中C原子形成4个单键,采取sp3杂化,在酯基
,﹣CH3中C原子形成4个单键,采取sp3杂化,在酯基 ![]() 中,C原子形成2个C﹣O单键,属于σ键,1个C=O双键,双键按单键计算,故中心C原子的杂化轨道数为3,采取sp2杂化,为平面正三角形,键角为120°,故O﹣C﹣O的键角约为120°,
中,C原子形成2个C﹣O单键,属于σ键,1个C=O双键,双键按单键计算,故中心C原子的杂化轨道数为3,采取sp2杂化,为平面正三角形,键角为120°,故O﹣C﹣O的键角约为120°,
所以答案是:MgO;MgO的晶格能大于NaCl的晶格能;sp2和sp3;120°;(4)F、Mg、K形成立方晶体结构的化合物,晶胞中F占据所有棱的中心,晶胞中F原子数目为12× ![]() =3,Mg位于顶角,晶胞中Mg原子数目为8×
=3,Mg位于顶角,晶胞中Mg原子数目为8× ![]() =1,K处于体心位置,晶胞中含有1个K原子,则该晶体的组成为F:Mg:K=3:1:1,
=1,K处于体心位置,晶胞中含有1个K原子,则该晶体的组成为F:Mg:K=3:1:1,
所以答案是:3:1:1;(5)含有元素K的盐的焰色反应为紫色,许多金属盐都可以发生焰色反应,其原因为:灼烧时电子从基态到激发态,当从激发态回到基态时放出能量以光的形式放出,从而出现不同的颜色,
所以答案是:紫;灼烧时电子从基态到激发态,当从激发态回到基态时放出能量以光的形式放出,从而出现不同的颜色.

【题目】如表为元素周期表的一部分.
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为 .
(2)表中元素原子半径最大的是(填元素符号) .
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是 . a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)沸点:H2YH2S(填“>”或“=”或“<”),理由是 .
(5)Y2和Y3互为(填“同位素”或“同分异构体”或“同素异形体”).
(6)其中单质Y2可用做如图所示装置(燃料电池)的氧化剂,请写出Y2在酸性电解质溶液中发生的电极反应方程式 . 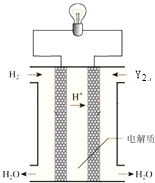
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂恰好变色,且30分钟不变化,测得所耗盐酸的体积为V1mL;
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)锥形瓶中的溶液从色变为色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察;
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 , 由此造成的测定结果(填偏高、偏低或无影响);
(4)步骤②缺少的操作是;
(5)如图,是某次滴定时的滴定管中的液面,其读数为mL;
(6)根据如表数据:
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.10 |
请计算待测烧碱溶液的浓度为mol/L.