题目内容
11.(1)已知A、B、C、D是四种短周期元素,它们的原子序数依次增大.其中A、D元素同主族且A是原子半径最小的元素,B、C元素同周期,B的最外层电子数是次外层电子数的2倍;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙为其中的三种,它们的元素组成如表所示:| 化合物 | 甲 | 乙 | 丙 |
| 组成元素 | B、C | A、C | C、D |
请填写下列空白:甲的化学式为CO,乙的化学式为H2O2,丙的化学式为Na2O2,其中丙中阴离子与阳离子的个数之比为1:2.
(2)工业上常用SO2除去CO,生成物为S和CO2.
已知:S(s)+O2(g)=SO2(g)△H=a kJ/mol
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=b kJ/mol
则反应SO2(g)+2CO(g)=S (s)+2CO (g) 的△H=(2b-a)kJ/mol
(3)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2.已知:2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
则CO和H2O(g)作用生成CO2和H2的热化学方程式为CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ•moL-1
(4)某同学设计了一个CH3OH燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如图:
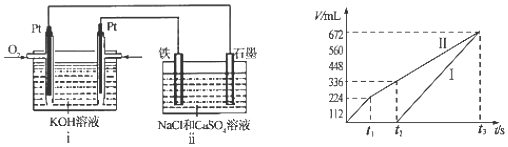
①写出ⅰ装置中通入甲醇这一极的电极反应式CH3OH+8OH--6e-=CO32-+6H2O.
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图所示(气体体积已换算成标准状况下的体积),则曲线I表示阴极电极上的反应情况(填“阴极”或“阳极”).写出在t1后,石墨电极上的电极反应式4OH--4e-=O2↑+2H2O (或2H2O-4e-=O2↑+4H+).
分析 (1)A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、D元素同主族且A是原子半径最小的元素,所以A是氢元素,B、C元素同周期,B的最外层电子数是次外层电子数的2倍,所以是碳;,由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲物质为有剧毒的气体,密度略小于空气;且B、C同周期,则甲是CO,所以B是C、C是O元素;
乙物质为液体,乙是A、C元素组成,则乙是H2O2,D与A同一主族,且原子序数D大于C,所以D是Na元素;
由C、D组成,且原子个数之比为1:1,则丁是Na2O2,再结合物质结构、性质解答;
(2)①S(s)+O2(g)=SO2(g)△H=a kJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=b kJ/mol
由盖斯定律目标反应的△H=2②-①;
(3)利用盖斯定律,根据已知热化学方程式乘以合适的系数进行相应加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减;
(4)①甲醇发生氧化反应,在碱性条件下生成碳酸根离子与水;
②图1中原电池通入甲醇的为负极,乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu:Cu2++2e-=Cu,故图2中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,阴极2Cu2++4e-=2Cu,t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极2Cu2++4e-=2Cu,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极4H++4e-=2H2↑.
解答 解:(1)A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、D元素同主族且A是原子半径最小的元素,所以A是氢元素,B、C元素同周期,B的最外层电子数是次外层电子数的2倍,所以是碳;,由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲物质为有剧毒的气体,密度略小于空气;且B、C同周期,则甲是CO,所以B是C、C是O元素;
乙物质为液体,乙是A、C元素组成,则乙是H2O2,D与A同一主族,且原子序数D大于C,所以D是Na元素;
由C、D组成,且原子个数之比为1:1,则丁是Na2O2,甲的化学式为CO,乙的化学式为H2O2,丙的化学式为Na2O2,其中丙中阴离子与阳离子的个数之比为1:2,故答案为:CO;H2O2;Na2O2;1:2;
(2)①S(s)+O2(g)=SO2(g)△H=a kJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=b kJ/mol
由盖斯定律目标反应的△H=2②-①=(2b-a)kJ/mol,故答案为:2b-a;
(2)已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ•moL-1
②2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ•moL-1
根据盖斯定律,①-②得2CO(g)+2H2O(g)=2H2(g)+2CO2(g)△H=-566kJ•moL-1-(-483.6KJ•moL-1)=-82.4KJ•moL-1.
即CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ•moL-1,
故答案为:CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ•moL-1;
(4)①在燃料电池的中,负极上是燃料发生失电子的氧化反应,在碱性环境下,甲醇失电子的过程为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
②图1中原电池通入甲醇的为负极,乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu:Cu2++2e-=Cu,故图2中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,阴极2Cu2++4e-=2Cu,t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极2Cu2++4e-=2Cu,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极4H++4e-=2H2↑,
故答案为:阴极; 4OH--4e-=O2↑+2H2O (或2H2O-4e-=O2↑+4H+).
点评 本题考查了元素化合物的知识、电解池原理等知识点,电解硫酸铜和氯化钠混合溶液时,明确离子的放电顺序是解本题的关键,难度较大.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案| A. | MgCl2 | B. | NaOH | C. | CaO | D. | SO2 |
| A. | 抗酸药能中和胃里过多的盐酸,缓解胃部不适,是一类治疗胃痛的药 | |
| B. | 碳酸镁、碳酸钡都能制成抗酸药 | |
| C. | 青霉素有阻止多种细菌生长的优异功能,虽经1×107 倍稀释,仍有疗效 | |
| D. | 青霉素是重要的消炎药 |
| A. | 原溶液中可能含有K+,一定没有HCO3-和OH-,将产生的无色气体通入澄清石灰水中,澄清石灰水变浑浊 | |
| B. | 原溶液中一定含有Cl-和NO3-,可能含有SO42-,反应生成的无色气体遇空气变红棕色 | |
| C. | 原溶液中所含的阳离子为Mg2+、Fe2+,加入稀盐酸所发生的反应为3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| D. | 若向原溶液中加入过量NaOH溶液,将所得沉淀过滤、洗涤、灼烧到恒重,得到的固体质量为107 g |
| A. | 0.24mol | B. | 0.21mol | C. | 0.25mol | D. | 0.12mol |
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 2.8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3.0 |
(2)达到平衡后,保持温度和体积不变,向甲容器内再充入0.8molH2O和3.2molH2,则此时V正=V逆
(填“>”、“<”或“=”)
(3)在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是BD.
A.V逆(CO2)═2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均相对分子质量保持不变
(4)某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:
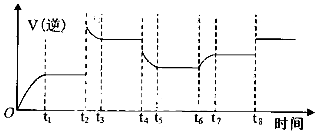
可见在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是通入H2O,则从t1到t8哪个时间段H2O (g)的平衡转化率最低t7-t8,(填“t1~t2,以此类推”).
| A. | 用激光笔光束鉴别氯化铁溶液和氢氧化铁胶体 | |
| B. | 用KSCN溶液鉴别Fe3+和Fe2+ | |
| C. | 用NaOH溶液和红色石蕊试纸鉴别溶液是否含NH4+ | |
| D. | 在氢氧化钠溶液中滴入氯化铁饱和溶液可以制得氢氧化铁胶体 |
 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题: