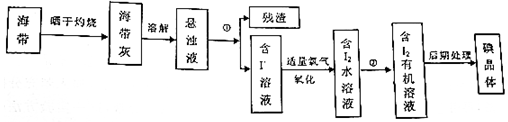
题目内容
16.向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的CO在加热下还原相同质量的混合物,最终得到铁的物质的量为( )| A. | 0.24mol | B. | 0.21mol | C. | 0.25mol | D. | 0.12mol |
分析 混合物与硝酸反应时恰好使混合物完全溶解,且所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为硝酸亚铁.由铁元素守恒可知,足量的CO在加热下还原相同质量的混合物,能得到铁的物质的量与硝酸亚铁中的铁的物质的量相同,根据硝酸的物质的量和生成NO的物质的量,求出溶液中硝酸亚铁的物质的量.
解答 解:因一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,无血红色出现,说明溶液中的溶质为硝酸亚铁,
根据氮元素守恒,硝酸亚铁中的硝酸根离子的物质的量为0.12L×4mol/L-$\frac{1.344L}{22.4L/mol}$=0.42mol,所以硝酸亚铁的物质的量为$\frac{0.42mol}{2}$=0.21mol,由铁元素守恒可知,得到铁的物质的量为n(Fe)=0.21mol.
故选B.
点评 本题考查学生利用原子守恒的方法来计算,明确硝酸亚铁与硝酸的关系,硝酸亚铁中铁元素与原混合物中的铁元素的关系是解答的关键.

练习册系列答案
相关题目
7.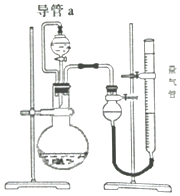 某兴趣小组的同学设计了如图装置进行试验探究,请回答下列问题:
某兴趣小组的同学设计了如图装置进行试验探究,请回答下列问题:
(1)为准确读取量气管的读数,除视线应与量气管凹液面最低处向平,还应注意使气体冷却至室温,量气管中的液面与漏斗中的液面要相平齐若考虑分液漏斗滴入烧瓶中液体的体积(假设其它操作都正确),则测得气体的体积将无影响(填“偏大”、“偏小”或“无影响”).
(2)若在烧瓶中放入生铁,用此装置验证生铁在潮湿空气中发生吸氧腐蚀.
①通过分液漏斗向烧瓶中加入的试剂可选用下列ac(填序号)
a.NaOH溶液 b.C2H5OH c.NaCl溶液 d.稀硫酸
②能证明生铁在潮湿空气中发生吸氧腐蚀的现象是量气管液面会下降.
(3)若烧瓶中放入粗铜片(杂质不参与反应),分液漏斗内放稀硝酸,通过收集并测量NO气体的体积来探究粗铜样品的纯度.你认为此方法是否可行不可行,铜与稀硝酸反应生成的NO会与空气的氧气反应生成二氧化氮,进而与水生成硝酸,会影响NO的体积的测定(填“可行”或“不可行”,若填“不可行”请说明原因).
(4)为探究MnO2在H2O2制取O2过程中的作用,将等量的H2O2加入烧瓶中,分别进行2次实验(气体体积在同一状况下测定):
若实验1中MnO2的作用是催化剂,则实验2中发生反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑、H2O2+MnO2+H2SO4=2H2O+O2↑+MnSO4.
(5)若烧瓶中放入镁铝合金,分液漏斗内放NaOH溶液,分别进行四次实验,测得以下数据(气体体积均已换算成标准状况):
则镁铝合金中镁的质量分数为73%.
 某兴趣小组的同学设计了如图装置进行试验探究,请回答下列问题:
某兴趣小组的同学设计了如图装置进行试验探究,请回答下列问题:(1)为准确读取量气管的读数,除视线应与量气管凹液面最低处向平,还应注意使气体冷却至室温,量气管中的液面与漏斗中的液面要相平齐若考虑分液漏斗滴入烧瓶中液体的体积(假设其它操作都正确),则测得气体的体积将无影响(填“偏大”、“偏小”或“无影响”).
(2)若在烧瓶中放入生铁,用此装置验证生铁在潮湿空气中发生吸氧腐蚀.
①通过分液漏斗向烧瓶中加入的试剂可选用下列ac(填序号)
a.NaOH溶液 b.C2H5OH c.NaCl溶液 d.稀硫酸
②能证明生铁在潮湿空气中发生吸氧腐蚀的现象是量气管液面会下降.
(3)若烧瓶中放入粗铜片(杂质不参与反应),分液漏斗内放稀硝酸,通过收集并测量NO气体的体积来探究粗铜样品的纯度.你认为此方法是否可行不可行,铜与稀硝酸反应生成的NO会与空气的氧气反应生成二氧化氮,进而与水生成硝酸,会影响NO的体积的测定(填“可行”或“不可行”,若填“不可行”请说明原因).
(4)为探究MnO2在H2O2制取O2过程中的作用,将等量的H2O2加入烧瓶中,分别进行2次实验(气体体积在同一状况下测定):
| 序号 | 烧瓶中的物质 | 测得气体体积 |
| 实验1 | 20mL H2O2,足量MnO2 | V1 |
| 实验2 | 20mL H2O2,足量MnO2和稀硫酸 | V1<V2<2V1 |
(5)若烧瓶中放入镁铝合金,分液漏斗内放NaOH溶液,分别进行四次实验,测得以下数据(气体体积均已换算成标准状况):
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| Ⅰ | 1.0g | 10.00mL | 346.30mL |
| Ⅱ | 1.0g | 10.00mL | 335.50mL |
| Ⅲ | 1.0 g | 10.00mL | 346.00mL |
| Ⅳ | 1.0g | 10.00mL | 345.70mL |
11.(1)已知A、B、C、D是四种短周期元素,它们的原子序数依次增大.其中A、D元素同主族且A是原子半径最小的元素,B、C元素同周期,B的最外层电子数是次外层电子数的2倍;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙为其中的三种,它们的元素组成如表所示:
常温下,甲物质为有剧毒的气体,密度略小于空气;乙物质为液体;丙物质为固体且为离子化合物.
请填写下列空白:甲的化学式为CO,乙的化学式为H2O2,丙的化学式为Na2O2,其中丙中阴离子与阳离子的个数之比为1:2.
(2)工业上常用SO2除去CO,生成物为S和CO2.
已知:S(s)+O2(g)=SO2(g)△H=a kJ/mol
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=b kJ/mol
则反应SO2(g)+2CO(g)=S (s)+2CO (g) 的△H=(2b-a)kJ/mol
(3)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2.已知:2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
则CO和H2O(g)作用生成CO2和H2的热化学方程式为CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ•moL-1
(4)某同学设计了一个CH3OH燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如图:
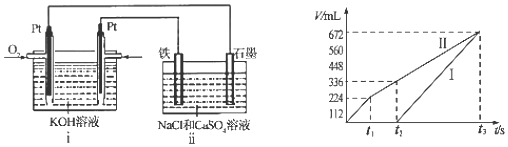
①写出ⅰ装置中通入甲醇这一极的电极反应式CH3OH+8OH--6e-=CO32-+6H2O.
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图所示(气体体积已换算成标准状况下的体积),则曲线I表示阴极电极上的反应情况(填“阴极”或“阳极”).写出在t1后,石墨电极上的电极反应式4OH--4e-=O2↑+2H2O (或2H2O-4e-=O2↑+4H+).
| 化合物 | 甲 | 乙 | 丙 |
| 组成元素 | B、C | A、C | C、D |
请填写下列空白:甲的化学式为CO,乙的化学式为H2O2,丙的化学式为Na2O2,其中丙中阴离子与阳离子的个数之比为1:2.
(2)工业上常用SO2除去CO,生成物为S和CO2.
已知:S(s)+O2(g)=SO2(g)△H=a kJ/mol
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=b kJ/mol
则反应SO2(g)+2CO(g)=S (s)+2CO (g) 的△H=(2b-a)kJ/mol
(3)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2.已知:2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
则CO和H2O(g)作用生成CO2和H2的热化学方程式为CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ•moL-1
(4)某同学设计了一个CH3OH燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如图:

①写出ⅰ装置中通入甲醇这一极的电极反应式CH3OH+8OH--6e-=CO32-+6H2O.
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图所示(气体体积已换算成标准状况下的体积),则曲线I表示阴极电极上的反应情况(填“阴极”或“阳极”).写出在t1后,石墨电极上的电极反应式4OH--4e-=O2↑+2H2O (或2H2O-4e-=O2↑+4H+).
 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中的信息,填写空格.

 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: