题目内容
20.根据以下装置图,填表并回答问题: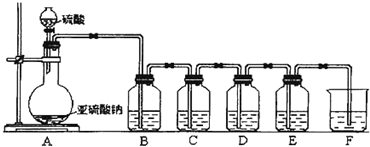
B紫色石蕊试剂 C品红溶液 D氢硫酸 E 溴水
(1)D瓶中的现象出现浅黄色沉淀,发生反应的化学方程式是H2S+SO2═3S↓+2H2O.
(2)F的作用是除去SO2气体,避免污染空气,F中盛放的液体可以是NaOH溶液,发生反应的化学方程式是SO2+2NaOH═Na2SO3.
(3)B、C、D E四瓶现象体现了SO2的化学性质,依次写出SO2的化学性质酸性、漂白性、氧化性、还原性.
分析 (1)硫化氢与二氧化硫反应生成淡黄色沉淀S单质,据此写出反应的化学方程式;
(2)二氧化硫有毒,需要用氢氧化钠溶液吸收;二氧化硫为酸性氧化物,能够与氢氧化钠溶液反应生成亚硫酸钠,据此写出反应的化学方程式;
(3)二氧化硫溶液显示酸性,能够使紫色石蕊试液变红;二氧化硫能够使品红溶液褪色;二氧化硫与硫化氢反应生成S单质,根据化合价变化可知二氧化硫表现了氧化性;二氧化硫具有还原性,能够与溴水发生氧化还原反应.
解答 解:(1)硫化氢与二氧化硫的反应为:H2S+SO2═3S↓+2H2O,所以D瓶中出现浅黄色沉淀,
故答案为:出现浅黄色沉淀;H2S+SO2═3S↓+2H2O;
(2)二氧化硫是一种有毒气体,为了避免污染空气,多余的二氧化硫需要用碱液吸收,二氧化硫与氢氧化钠溶液反应的化学方程式为:SO2+2NaOH═Na2SO3,
故答案为:除去SO2气体,避免污染空气;NaOH溶液; SO2+2NaOH═Na2SO3;
(3)二氧化硫溶液显示酸性,所以B中紫色石蕊试液变红,证明了二氧化硫具有酸性;二氧化硫通入C中的品红溶液时,品红溶液褪色,证明二氧化硫具有漂白性;二氧化硫与硫化氢发生反应为:SO2+2NaOH═Na2SO3,该反应中硫元素化合价从+4变为0价,化合价降低被还原,二氧化硫在反应中表现了氧化性;二氧化硫能够被溴水氧化呈硫酸,二氧化硫表现了还原性,
故答案为:酸性;漂白性;氧化性;还原性.
点评 本题考查了二氧化硫的制取与性质,题目难度中等,明确二氧化硫的性质及检验方法为解答关键,注意掌握二氧化硫漂白原理,试题侧重考查学生的分析能力及化学实验能力.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
19.下列变化的实质相似的是( )
①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小
②二氧化硫和氯气均能使品红溶液褪色
③二氧化硫能使品红溶液和溴水褪色
④溴化氢和碘化氢气体均不能用浓硫酸干燥
⑤浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字.
①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小
②二氧化硫和氯气均能使品红溶液褪色
③二氧化硫能使品红溶液和溴水褪色
④溴化氢和碘化氢气体均不能用浓硫酸干燥
⑤浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字.
| A. | 只有②③④ | B. | 只有④ | C. | 只有③④ | D. | 全部 |
8.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1mol氯气参加氧化还原反应,转移的电子数一定为2 NA | |
| B. | 0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3NA | |
| C. | 常温常压下,44g二氧化碳分子中所形成的共用电子对数为2 NA | |
| D. | 常温常压下,1.6gO2和O3混合气体中质子总数为0.8NA |
15.要检验某溴乙烷中的溴元素,正确的实验方法是( )
| A. | 加入氯水振荡,观察水层是否有棕红色溴出现 | |
| B. | 滴入AgNO3溶液,再加入稀硝酸呈酸性,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 |
12.用下列装置进行相应实验,能达到实验目的是( )
| A. |  图为牺牲阳极的阴极保护法,可以防止铁棒被腐蚀 | |
| B. |  图所示装置可以检验溴乙烷与NaOH醇溶液共热产生的乙烯 | |
| C. |  图所示装置可以用来制备氢氧化亚铁 | |
| D. |  图所示装置可以用来测定中和热 |
9.下列烷烃的系统命名中,正确的是( )
| A. | 2,3-二甲基丁烷 | B. | 2-二甲基戊烷 | ||
| C. | 3,3-二甲基丁烷 | D. | 3-甲基-2-乙基己烷 |
10.短周期元素 X、Y、Z、R、W 五种元素原子序数依次增大,其中X与Z、Y与W分别为同族元素.原子半径 X<Y<W<R<Z,W原子的最外层电子数比内层电子总数少4,Z、R的核外电子数之和与Y、W核外电子数之和相等.下列说法不正确的是( )
| A. | Y、Z、R的简单离子具有相同的电子层结构 | |
| B. | X2Y的熔点和沸点均比X2W高,是因为X2Y的分子内存在氢键 | |
| C. | X、Z分别与Y均可形成AB与A2B2型化合物,且A2B2均有较强的氧化性 | |
| D. | 由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生复分解反应 |
