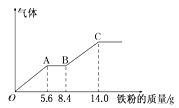
题目内容
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA
B. 0.1 mol/L NH4Cl溶液中Cl-离子数目为0.1 NA
C. 反应3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92 kJ/mol,放出热量9.2 kJ时,转移电子0.6 NA
2NH3(g) ΔH=-92 kJ/mol,放出热量9.2 kJ时,转移电子0.6 NA
D. 0.1 mol H2O2分子中含极性共价键数目为0.3 NA
【答案】C
【解析】试题分析:A、7.2gCaO2晶体的物质的量n=![]() =
=![]() =0.1mol,而CaO2晶体中含1个钙离子和1个过氧根离子,故0.1molCaO2中含0.2mol离子,故A错误;B、溶液体积不明确,故无法计算氯离子数目,故B错误;C、反应3H2(g)+N2(g)2NH3(g)△H="-92" kJ/mol转移6mol电子,放出热量9.2 kJ时,转移电子0.6 NA,故C正确;D、H2O2分子中含2个极性共价键,故0.1 mol H2O2分子中含极性共价键数目为0.2 NA,故D错误;故选C。
=0.1mol,而CaO2晶体中含1个钙离子和1个过氧根离子,故0.1molCaO2中含0.2mol离子,故A错误;B、溶液体积不明确,故无法计算氯离子数目,故B错误;C、反应3H2(g)+N2(g)2NH3(g)△H="-92" kJ/mol转移6mol电子,放出热量9.2 kJ时,转移电子0.6 NA,故C正确;D、H2O2分子中含2个极性共价键,故0.1 mol H2O2分子中含极性共价键数目为0.2 NA,故D错误;故选C。

练习册系列答案
相关题目
【题目】
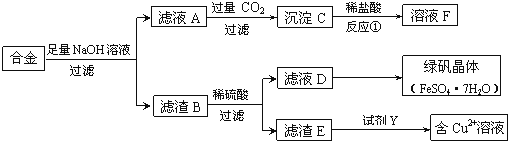
(1)合金与足量氢氧化钠溶液反应的离子方程式是 。
(2)若D中含有Fe3+,除去Fe3+的常用试剂是 。
(3)若要从滤液D中得到绿矾晶体,必须进行的实验操作步骤: 、冷却结晶、过滤、自然干燥。
(4)若由滤渣E得到含Cu2+的溶液,试剂Y可能是 (填选项字母)。
A.稀硝酸 | B.浓硫酸 | C.浓盐酸 | D.稀硫酸 |
根据所选试剂写出一个由滤渣E得到含Cu2+溶液的化学方程式: 。