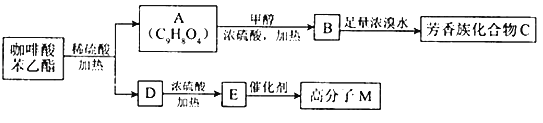
��Ŀ����
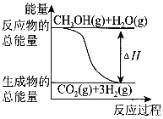
����Ŀ��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�á�
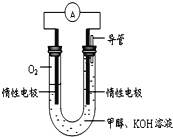
��1���õ����OH����_______���ƶ�(����������������)
��2���õ�ظ����ĵ缫��ӦΪ___________________
��3���øõ�ص��(���Ե缫)500 mLijCuSO4��Һ�����һ��ʱ���Ϊʹ�������Һ�ָ���ԭ״̬����Ҫ����Һ�м���9.8 g Cu(OH)2���塣��ԭCuSO4��Һ�����ʵ���Ũ��Ϊ_______________�����������ռ�����״���µ��������Ϊ_____________��
���𰸡���1��������2��CH3OH-6e-+8OH-=CO32-+6H2O ��3��0.2mol/L��4.48L
��������
�����������1��ԭ����������������õ����OH�����ƶ�����2���״�ȼ�ϵ�أ�ͨ��״���һ��Ϊ����������������Ӧ���õ�ظ����ĵ缫��ӦΪCH3OH-6e-+8OH-=CO32-+6H2O����3������9.8g Cu��OH��2������ʹ�������Һ�ָ�ԭ״��n[Cu��OH��2]= ![]() =0.1mol���൱�ڼ���0.1molCuO��0.1molH2O������Cuԭ���غ��n��CuSO4��=n[Cu��OH��2]=0.1mol����C��CuSO4��=
=0.1mol���൱�ڼ���0.1molCuO��0.1molH2O������Cuԭ���غ��n��CuSO4��=n[Cu��OH��2]=0.1mol����C��CuSO4��=![]() =0.2mol/L������Oԭ���غ��n��O2��=n[Cu��OH��2]=0.1mol������Hԭ���غ��n��H2��=n[Cu��OH��2]=0.1mol�����������=��0.1+0.1��mol��22.4L/mol=4.48L��
=0.2mol/L������Oԭ���غ��n��O2��=n[Cu��OH��2]=0.1mol������Hԭ���غ��n��H2��=n[Cu��OH��2]=0.1mol�����������=��0.1+0.1��mol��22.4L/mol=4.48L��

 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�