题目内容
(2011?开封一模)分析如下残缺的反应:RO3-+
1
1
+6H+=3R2↑+3H2O.下列叙述正确的是( )分析:首先判断:RO3-中R的化合价不一定是最高价态,不能用作最高化合价来判断在周期表中的位置,根据电子得失守恒,R元素由RO3-中的+5价降低而被还原为R2中的0价,RO3-得到5e-,则缺项物质及系数为5R-,R-中R为-1价,是R的最低价态,根据R元素的最低价态或最高价态推导其一定位于第VIIA族,根据同周期原子半径的递变规律判断原子半径的大小,根据化合价的变化来判断氧化还原反应中的有关概念问题.
解答:解:A、根据电子得失守恒,R元素由RO3-中的+5价降低而被还原为R2中的0价,RO3-得到5e-,则缺项物质及系数为5R-,5R-失去5e-,在反应中作还原剂,R元素由-1价升高而被氧化为R2中的0价,则R应为第故ⅧA族,故A错;
B、根据R元素的最低价态或最高价态推导其一定位于第VIIA族,同周期元素原子半径递减(稀有气体除外),因此同周期元素中卤素的原子半径最小,故B正确;
C、R-中R为-1价,是R的最低价态,被氧化后化合价升高,在反应中做还原剂,故C错;
D、R的最高价态为+7价,则RO3-中的+5价是R的中间价态,既能升高又能降低,因此既能被氧化又能被还原,故D错.
故选B.
B、根据R元素的最低价态或最高价态推导其一定位于第VIIA族,同周期元素原子半径递减(稀有气体除外),因此同周期元素中卤素的原子半径最小,故B正确;
C、R-中R为-1价,是R的最低价态,被氧化后化合价升高,在反应中做还原剂,故C错;
D、R的最高价态为+7价,则RO3-中的+5价是R的中间价态,既能升高又能降低,因此既能被氧化又能被还原,故D错.
故选B.
点评:本题为氧化反应反应和推断题相结合的题目,该题的关键一步为根据残缺的方程式判断R的最低价态,以此进一步判断在周期表中的位置和反应中的化合价变化问题.本题有较大难度,但重在从题给信息中抓住氧化还原反应的规律.

练习册系列答案
相关题目
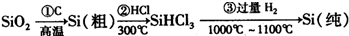

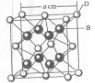 (2011?开封一模)[化学--选修物质结构与性质]
(2011?开封一模)[化学--选修物质结构与性质]
