题目内容
某同学用10mol/L的浓盐酸配制250mL 1mol/L的稀盐酸,并进行有关实验.请回答下列问题:
(1)需要量取浓盐酸______mL.
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有______、______等.
(3)取所配制的稀盐酸100mL,与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为______g,设反应后溶液的体积仍为100mL,则反应后溶液中H+的物质的量浓度为______.
解:(1)设浓盐酸的体积为V,则10mol×V=1mol/L×0.25L,V=0.025L=25mL,故答案为:25;
(2)用胶头滴管定容,用250mL容量瓶配制溶液,故答案为:胶头滴管;250mL容量瓶;
(3)盐酸和锌反应的方程式为:Zn+2HCl=ZnCl2+H2↑,设参加反应的锌的质量为x,参加反应的盐酸的物质的量为y.
Zn+2HCl=ZnCl2+H2↑
65g 2mol 22.4L
x y 0.896L
x=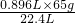 =2.6g
=2.6g
y=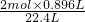 =0.08mol,
=0.08mol,
剩余盐酸的物质的量=1mol/L×0.1l-0.08mol=0.02mol,
则氢离子浓度=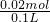 =0.2mol/L,
=0.2mol/L,
故答案为:2.6;0.2mol/L.
分析:(1)根据溶液稀释前后溶质的物质的量相等计算浓盐酸的体积;
(2)根据各仪器的作用选取仪器;
(3)根据氢气和锌之间的关系式计算锌的质量,根据元素守恒计算氢离子的物质的量,再根据物质的量浓度公式计算氢离子浓度.
点评:本题考查了溶液的稀释、仪器的选择、根据方程式进行计算等知识点,难度不大,注意选择的容量瓶要写规格,为易错点.
(2)用胶头滴管定容,用250mL容量瓶配制溶液,故答案为:胶头滴管;250mL容量瓶;
(3)盐酸和锌反应的方程式为:Zn+2HCl=ZnCl2+H2↑,设参加反应的锌的质量为x,参加反应的盐酸的物质的量为y.
Zn+2HCl=ZnCl2+H2↑
65g 2mol 22.4L
x y 0.896L
x=
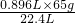 =2.6g
=2.6gy=
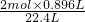 =0.08mol,
=0.08mol,剩余盐酸的物质的量=1mol/L×0.1l-0.08mol=0.02mol,
则氢离子浓度=
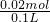 =0.2mol/L,
=0.2mol/L,故答案为:2.6;0.2mol/L.
分析:(1)根据溶液稀释前后溶质的物质的量相等计算浓盐酸的体积;
(2)根据各仪器的作用选取仪器;
(3)根据氢气和锌之间的关系式计算锌的质量,根据元素守恒计算氢离子的物质的量,再根据物质的量浓度公式计算氢离子浓度.
点评:本题考查了溶液的稀释、仪器的选择、根据方程式进行计算等知识点,难度不大,注意选择的容量瓶要写规格,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目