题目内容
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H="-76.0" kJ·mol一1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H="+113.4" kJ·mol一1,则反应:3FeO(s)+ H2O(g)= Fe3O4(s)+ H2(g)的△H=__________。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4 H2 (g) 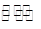 C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如
图所示: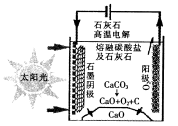
①上述生产过程的能量转化方式是____________________。
②上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为___________________。
(1)①2;②+18.7 kJ·mol-1(2)80%;25;<
(3)①太阳能和电能转化为化学能;②2CO32--4e-=2CO2↑+O2↑
解析试题分析:(1)①由6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)知,反应方程式FeO中铁元素化合价+2升至Fe3O4中+ ,CO2由+4降至C中碳元素的0价,每生成1molC转移电子4mol,生成Fe3O4 2mol ,则生成1 mol Fe3O4转移电子2mol;②反应1:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s),△H1="-76.0" kJ/mol;反应2:C(s)+2H2O(g)=CO2(g)+2H2(g),△H2="+113.4" kJ/mol,根据盖斯定理△H=
,CO2由+4降至C中碳元素的0价,每生成1molC转移电子4mol,生成Fe3O4 2mol ,则生成1 mol Fe3O4转移电子2mol;②反应1:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s),△H1="-76.0" kJ/mol;反应2:C(s)+2H2O(g)=CO2(g)+2H2(g),△H2="+113.4" kJ/mol,根据盖斯定理△H= (△H1+△H2)=
(△H1+△H2)= (-76.0+113.4)="+18.7" kJ/mol(2)2 L的恒容密闭容器中反应达到平衡时CH4浓度为0.8 mol/L,CO2浓度为0.2 mol/L,由题意知CO2(g)+4H2(g)
(-76.0+113.4)="+18.7" kJ/mol(2)2 L的恒容密闭容器中反应达到平衡时CH4浓度为0.8 mol/L,CO2浓度为0.2 mol/L,由题意知CO2(g)+4H2(g)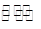 CH4(g)+2H2O(g),反应的CO2与生成的CH4的物质量相等,CO2的平衡转化率为
CH4(g)+2H2O(g),反应的CO2与生成的CH4的物质量相等,CO2的平衡转化率为 =
= =80%;300 ℃时上述反应的平衡常数K=
=80%;300 ℃时上述反应的平衡常数K= =25;由题意知300 ℃时,K=25,200℃时,K=64.8,对正反应为吸热的可逆反应,升高温度,平衡正向移动,正反应的程度增大,K增大,对正反应为放热的可逆反应,升高温度,平衡逆向移动,正反应的程度减小,K减小,则该反应为放热反应,△H<0(3)由图知,是用吸收的太阳能和电源电能进行反应能量的来源,故太阳能和电能转化为化学能;电解反应中阳极失电子发生氧化反应,由图知反应产物为O2,又电解质为熔融碳酸钠,故反应方程式:2CO32--4e-=2CO2↑+O2↑。
=25;由题意知300 ℃时,K=25,200℃时,K=64.8,对正反应为吸热的可逆反应,升高温度,平衡正向移动,正反应的程度增大,K增大,对正反应为放热的可逆反应,升高温度,平衡逆向移动,正反应的程度减小,K减小,则该反应为放热反应,△H<0(3)由图知,是用吸收的太阳能和电源电能进行反应能量的来源,故太阳能和电能转化为化学能;电解反应中阳极失电子发生氧化反应,由图知反应产物为O2,又电解质为熔融碳酸钠,故反应方程式:2CO32--4e-=2CO2↑+O2↑。
考点:电子守恒;盖斯定理的计算;反应平衡常数的计算;反应热与焓变;电解原理

氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据图1提供的信息,写出该反应的热化学方程式: ,在图1中曲线 (填“a”或“b”)表示加入铁触媒的能量变化曲线。 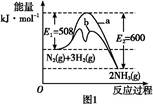
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是 。
A.3v(H2)正=2v(NH3)逆
B.单位时间内生成n mol N2的同时生成2n mol NH3
C.混合气体的密度不再改变
D.容器内压强不随时间的变化而变化
(3)一定温度下,向2 L密闭容器中充入1 mol N2和3 mol H2,保持体积不变,0.5 min后达到平衡,测得容器中有0.4 mol NH3,则平均反应速率v(N2)= ,该温度下的平衡常数K= 。若升高温度,K值变化 (填“增大”、“减小”或“不变”)。
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 | T(℃) | n(N2)/n(H2) | p(MPa) |
| ⅰ | 450 | 1/3 | 1 |
| ⅱ | | | 10 |
| ⅲ | 480 | | 10 |
A.请在上表空格中填入剩余的实验条件数据。
B.根据反应N2(g)+3H2(g)
 2NH3(g)的特点,在给出的坐标图2中,画出其在1 MPa和10 MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
2NH3(g)的特点,在给出的坐标图2中,画出其在1 MPa和10 MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
| 实验 编号 | 温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
| 1 | 130 ℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180 ℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | | 0.15 |
(1)开展实验1和实验2的目的是______________________________。
(2)180 ℃时,反应到40 min,体系________(填“是”或“否”)达到平衡状态,理由是__________________________;
CH4的平衡转化率为________。
(3)已知130 ℃时该反应的化学平衡常数为6.4,试计算a的值。(写出计算过程)
(4)一定条件下,反应时间t与转化率α(NO2)的关系如图所示,请在图像中画出180 ℃时,压强为p2(设压强p2>p1)的变化曲线,并做必要的标注。

(5)根据已知求算:ΔH2=________。
CH4(g)+4NO2(g)
 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1CH4(g)+4NO(g)
 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2 铜单质及其化合物在工业生产和科研中有重要作用。
(1)已知:2Cu2O(s) + O2(g) = 4CuO(s)△H=-292kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式: ;
(2)现用氯化铜晶体(CuCl2·2H2O,含氯化亚铁杂质)制取纯净的CuCl2·2H2O。先将其制成水溶液,后按如图步骤进行提纯: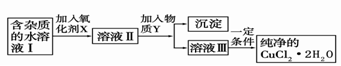
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表
| 金属离子 | Fe3+ | Fe2+[来源:学&科& | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
①现有氧化剂NaClO、H2O2、KMnO4,X加哪种好,为什么?
;该反应的离子方程式为 。
②溶液II中除Cu2+外,还有 金属离子,如何检验其存在 。
③物质Y不能为下列的
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3 e.CaO f.NaOH
④若向溶液Ⅱ中加入碳酸钙,产生的现象是 。
“温室效应”是哥本哈根气候变化大会研究的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有 (填字母)。
A.采用节能技术,减少化石燃料的用量
B.鼓励乘坐公交车出行,倡导低碳生活
C.利用太阳能、风能等新型能源替代化石燃料
(2)一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)=C2H4(g)+3O2(g) △Hl="+1411.0" kJ/mol
2CO2(g)+3H2O(l)=C2H5OH(l)+3O2(g) △H2="+1366.8" kJ/mol
则由乙烯水化制乙醇的热化学方程式是 。
(3)在一定条件下,6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
| 温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
根据上表中数据分析:
①温度一定时,提高氢碳比[
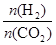 ],CO2的转化率 (填“增大”“减小”或“不变”)。
],CO2的转化率 (填“增大”“减小”或“不变”)。②该反应的正反应为 (填“吸”或“放”)热反应。
(4)下图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则b处通入的是 (填“乙醇”或“氧气”),a处发生的电极反应是 。
雾霾已经严重影响我们的生存环境。火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。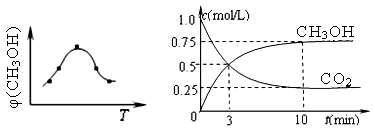
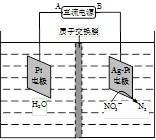
图22-1 图22-2 图22-3
(1)利用甲烷催化还原NOx:
①CH4(g) + 4NO2(g) =" 4NO(g)" + CO2(g) + 2H2O(g) △H1=-574kJ?mol-1
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)将CO2转化为甲醇的热化学方程式为:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线(见图22-1),则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图22-2所示。
下列说法正确的是 (填字母代号)。
| A.第10min后,向该容器中再充入1molCO2和3molH2,则再次达到平衡时c(CH3OH) ="1.5" mol/L |
| B.达到平衡时,氢气的转化率为0.75 |
| C.0~10分钟内,氢气的平均反应速率为0.075mol/(L?min) |
| D.该温度下,反应的平衡常数的值为3/16 |
(3)某种脱硫工艺中将烟气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程为 。
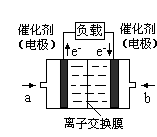
(4)电化学降解NO3- 的原理如题22-3图所示。
①电源正极为 (填“A”或“B”),阴极反应式为 。
②若电解过程中转移了1mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。

 4CO(g) + BaS(s) △H1=+ 571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1=+ 571.2 kJ·mol-1 ①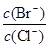 = 时,开始生成第二种沉淀,随着AgNO3溶液的进一步滴加,此时生成的沉淀以 为主,且
= 时,开始生成第二种沉淀,随着AgNO3溶液的进一步滴加,此时生成的沉淀以 为主,且 2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。 2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
 =-867kJ·mol-1
=-867kJ·mol-1 N2O4(g)
N2O4(g) 