��Ŀ����
NH3��Ϊһ����Ҫ����ԭ�ϣ�������Ӧ���ڹ�ҵ�����������й����ʷ�Ӧ�Ĵ����о������������863�ƻ���
(1)���������н�ǿ��ѡ���ԣ���רһ�ԡ���֪��
��ӦI��4NH3(g) +5O2(g) 4NO(g) +6H2O(g) ��H= -905.0 kJ��mol-1
4NO(g) +6H2O(g) ��H= -905.0 kJ��mol-1
��ӦII:4NH3(g)+3O2(g) 2N2(g) +6H2O(g) ��H= -1266.6 kJ��mol-1
2N2(g) +6H2O(g) ��H= -1266.6 kJ��mol-1
д��NO�ֽ�����N2��O2���Ȼ�ѧ����ʽ_____��
(2)�ں��º���װ���г���һ������NH3��O2,��ij�����������½��з�ӦI ,��ò�ͬʱ���NH3��O2,��Ũ�����±���
ʱ��(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol��L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
c(O2)/mol• L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
�������й���������ȷ����_____________��
A.ʹ�ô���ʱ���ɽ��÷�Ӧ�Ļ�ܣ��ӿ��䷴Ӧ����
B.�����������4v��(NH3) =6v��(H2O)ʱ��˵����Ӧ�Ѵ�ƽ��
C.��������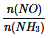 =1ʱ��˵����Ӧ�Ѵ�ƽ��
=1ʱ��˵����Ӧ�Ѵ�ƽ��
D.ǰ10�����ڵ�ƽ������v( NO)=0.088 mol��L-1��min-1
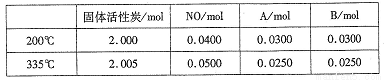
(3)��������ʱ�ᷢ����������������ӦI��II��Ϊ����ij�����Ը÷�Ӧ��ѡ���ԣ���1L�ܱ������г���1 mol NH3��2mol O2������й����ʵ�����ϵ����ͼ��
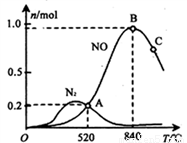
�ٸô����ڵ���ʱѡ��Ӧ_______(� I ���� II������
��52��ʱ��4NH3+3O2 2N2+6H2O��ƽ�ⳣ��K=_______(��Ҫ��ó���������ֻ���г����ּ���ʽ����
2N2+6H2O��ƽ�ⳣ��K=_______(��Ҫ��ó���������ֻ���г����ּ���ʽ����
��C���B����������NO�����ʵ����ٵ���Ҫԭ��________��
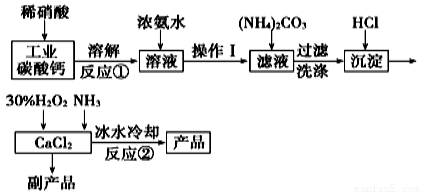
(4)�Ʊ�����ʱ������һ���ķ�Һ����ҵ�ϳ�������������ͳ�ȥ��Һ�е�Cu2+��
��֪��25��ʱ��K1(H2S) =1.3��10-7��K1(H2S) =7.1��10-15��Ksp(CuS) =8.5��10-45
���ڼ�����Һ�е�����Ũ��ʱ���漰����ĵ���ͨ��Ҫ���н��ƴ�������0.lmol •L-1�������pH��______(ȡ������������
��ijͬѧͨ�����Ƽ��㷢��0.lmol •L-1��������0.0lmol •L-1�������е�c(S2-)��ȣ����ҵ���_____mol��L-1
����֪��ij��Һ�ӽ������ԣ������������������ᣬ����Һ��c(Cu2+) >_____ mol��L-1(������������λ��Ч���֣����ͻ����CuS������
 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д�

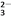 ===2I����S4O
===2I����S4O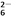 ��
��

 2Fe3++PbSO4+2H2O
2Fe3++PbSO4+2H2O