题目内容
设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 0.2mol的铁与足量的稀硝酸反应,生成气体的分子效目为0.3NA
B. 常温常压下,14g由C2H4、C3H6组成的混合气体中含有碳原子的数目为NA
C. 2.24LCO2与足量的Na2O2反应.转移的电子总数必为0.1NA
D. 1L1mol/L的KAl(SO4)2溶液中阳离子总数为2NA
 名校课堂系列答案
名校课堂系列答案NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g) 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
反应II:4NH3(g)+3O2(g) 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
写出NO分解生成N2与O2的热化学方程式_____。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I ,测得不同时间的NH3和O2,的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
c(O2)/mol• L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
则下列有关叙述中正确的是_____________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3) =6v逆(H2O)时,说明反应已达平衡
C.当容器内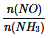 =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.前10分钟内的平均速率v( NO)=0.088 mol·L-1·min-1
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
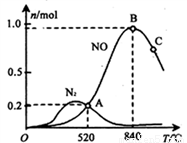
①该催化剂在低温时选择反应_______(填“ I ”或“ II”)。
②52℃时,4NH3+3O2 2N2+6H2O的平衡常数K=_______(不要求得出计算结果,只需列出数字计算式)。
2N2+6H2O的平衡常数K=_______(不要求得出计算结果,只需列出数字计算式)。
③C点比B点所产生的NO的物质的量少的主要原因________。
(4)制备催化剂时常产生一定的废液,工业上常利用氢硫酸检测和除去废液中的Cu2+。
已知:25℃时,K1(H2S) =1.3×10-7,K1(H2S) =7.1×10-15,Ksp(CuS) =8.5×10-45
①在计算溶液中的离子浓度时,涉及弱酸的电离通常要进行近似处理。则0.lmol •L-1氢硫酸的pH≈______(取近似整数)。
②某同学通过近似计算发现0.lmol •L-1氢硫酸与0.0lmol •L-1氢硫酸中的c(S2-)相等,而且等于_____mol·L-1
③已知,某废液接近于中性,若加入适量的氢硫酸,当废液中c(Cu2+) >_____ mol·L-1(计算结果保留两位有效数字),就会产生CuS沉淀。





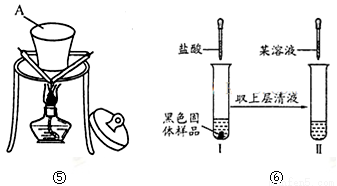

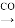 Ni(CO)4
Ni(CO)4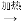 镍”的目的是__________。
镍”的目的是__________。 Cu2+
Cu2+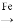 Cu)。
Cu)。