��Ŀ����
�о�̼�������仯�����ת�����ڻ����ĸ������ش����塣
��1��������ԭ������NOx��ת�����£�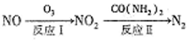
��֪��NO(g)+O3(g)=NO2(g)+O2(g) ��H=-200.9kJ/mol
2NO(g)��O2(g)=2NO(g) ��H=-116.2kJ/mol
��ӦI���Ȼ�ѧ����ʽΪ________________��
��2���������뽫CO�����з�Ӧ��ȥ��2CO(g)=2C(s)+O2(g) ��H>0����������������ܷ�ʵ�֣�______����ǡ���) ��������_____________��
��3��һ�������£�CO�����ĩ״�����������������ɼ����ơ���֪����ʱ������ĵ���ƽ�ⳣ��Ka=1.70��10-4��
�� �����Ƶ�ˮ��Һ�ʼ��ԣ��������ӷ�Ӧ����ʽ��ʾ��ԭ��___________��
�� ��20mL 0.1mol/L�ļ�������Һ�еμ�10ml 0.1mol/L�����ᣬ���Һ��______�ԣ���ᡱ�������Һ������Ũ�ȴӴ�С��˳��Ϊ______________��
��4������̿Ҳ�����ڴ�������β���е�NO����2L�����ܱ������м���0.1000molNO��2.030mol�������̿������A��B�������壬�ڲ�ͬ�¶��²��ƽ����ϵ�и����ʵ����ʵ������±���
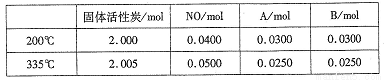
�ٸ÷�Ӧ������ӦΪ________(����ȡ����ȡ�)��Ӧ��
�� 200��ʱ��ƽ���������������ٳ���0.1molNO���ٴ�ƽ���NO�İٷֺ�����_____�������������С�����䡱����
�ۼ��㷴Ӧ��ϵ��335�� ʱ��ƽ�ⳣ��_______��
 Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�NH3��Ϊһ����Ҫ����ԭ�ϣ�������Ӧ���ڹ�ҵ�����������й����ʷ�Ӧ�Ĵ����о������������863�ƻ���
(1)���������н�ǿ��ѡ���ԣ���רһ�ԡ���֪��
��ӦI��4NH3(g) +5O2(g) 4NO(g) +6H2O(g) ��H= -905.0 kJ��mol-1
4NO(g) +6H2O(g) ��H= -905.0 kJ��mol-1
��ӦII:4NH3(g)+3O2(g) 2N2(g) +6H2O(g) ��H= -1266.6 kJ��mol-1
2N2(g) +6H2O(g) ��H= -1266.6 kJ��mol-1
д��NO�ֽ�����N2��O2���Ȼ�ѧ����ʽ_____��
(2)�ں��º���װ���г���һ������NH3��O2,��ij�����������½��з�ӦI ,��ò�ͬʱ���NH3��O2,��Ũ�����±���
ʱ��(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol��L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
c(O2)/mol• L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
�������й���������ȷ����_____________��
A.ʹ�ô���ʱ���ɽ��÷�Ӧ�Ļ�ܣ��ӿ��䷴Ӧ����
B.�����������4v��(NH3) =6v��(H2O)ʱ��˵����Ӧ�Ѵ�ƽ��
C.��������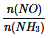 =1ʱ��˵����Ӧ�Ѵ�ƽ��
=1ʱ��˵����Ӧ�Ѵ�ƽ��
D.ǰ10�����ڵ�ƽ������v( NO)=0.088 mol��L-1��min-1
(3)��������ʱ�ᷢ����������������ӦI��II��Ϊ����ij�����Ը÷�Ӧ��ѡ���ԣ���1L�ܱ������г���1 mol NH3��2mol O2������й����ʵ�����ϵ����ͼ��
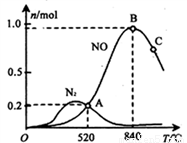
�ٸô����ڵ���ʱѡ��Ӧ_______(� I ���� II������
��52��ʱ��4NH3+3O2 2N2+6H2O��ƽ�ⳣ��K=_______(��Ҫ��ó���������ֻ���г����ּ���ʽ����
2N2+6H2O��ƽ�ⳣ��K=_______(��Ҫ��ó���������ֻ���г����ּ���ʽ����
��C���B����������NO�����ʵ����ٵ���Ҫԭ��________��
(4)�Ʊ�����ʱ������һ���ķ�Һ����ҵ�ϳ�������������ͳ�ȥ��Һ�е�Cu2+��
��֪��25��ʱ��K1(H2S) =1.3��10-7��K1(H2S) =7.1��10-15��Ksp(CuS) =8.5��10-45
���ڼ�����Һ�е�����Ũ��ʱ���漰����ĵ���ͨ��Ҫ���н��ƴ�������0.lmol •L-1�������pH��______(ȡ������������
��ijͬѧͨ�����Ƽ��㷢��0.lmol •L-1��������0.0lmol •L-1�������е�c(S2-)��ȣ����ҵ���_____mol��L-1
����֪��ij��Һ�ӽ������ԣ������������������ᣬ����Һ��c(Cu2+) >_____ mol��L-1(������������λ��Ч���֣����ͻ����CuS������


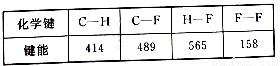
 H3O����S2��
H3O����S2��

 CH3CHBrCH===CH2
CH3CHBrCH===CH2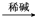 CH3CHOHCH2CHOCH3CHOHCH2CHO
CH3CHOHCH2CHOCH3CHOHCH2CHO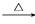 CH3CH===CHCHO��H2O
CH3CH===CHCHO��H2O B��
B��