题目内容
6.在2L密闭容器中加入4molSO2和2molO2,发生下列反应2SO2(g)+O2(g)?2SO3(g).(1)若充分反应后能否得到4molSO3?为什么?
(2)若经5s后,剩下的SO2为2.5mol,则用O2表示的反应速率是多少?5s末SO3浓度是多少?
分析 (1)反应是可逆反应不能进行彻底;
(2)结合化学平衡三段式列式计算,若经5s后,剩下的SO2为2.5mol,反应的二氧化硫物质的量=4mol-2.5mol=1.5mol
2SO2(g)+O2(g)?2SO3(g)
起始量(mol) 4 2 0
变化量(mol) 1.5 0.75 1.5
5s量 (mol) 2.5 1.25 1.5
反应速率V=$\frac{△c}{△t}$
物质浓度c=$\frac{n}{V}$.
解答 解:(1)题意可知反应是可逆反应,不能进行彻底,二氧化硫不能全部转化为三氧化硫,达到平衡状态生成三氧化硫物质的量小于4mol;
答:若充分反应后不能得到4molSO3 ,反应是可逆反应,不能进行彻底,二氧化硫不能全部转化为三氧化硫;
(2)若经5s后,剩下的SO2为2.5mol,反应的二氧化硫物质的量=4mol-2.5mol=1.5mol,
2SO2(g)+O2(g)?2SO3(g)
起始量(mol) 4 2 0
变化量(mol) 1.5 0.75 1.5
5s量 (mol) 2.5 1.25 1.5
用O2表示的反应速率V=$\frac{△c}{△t}$=$\frac{\frac{0.75mol}{2L}}{5s}$=0.075mol/(L•s)
5s末SO3浓度c=$\frac{n}{V}$=$\frac{1.5mol}{2L}$=0.75mol/L;
答:经5s后用O2表示的反应速率0.075mol/(L•s),SO3浓度为0.75mol/L;
点评 本题考查了化学平衡的计算应用,主要是反应达到平衡状态的分析理解,化学反应速率概念的计算应用,注意反应的可逆性,题目较简单.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案(CH3)2CHCH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l);△H=-2869kJ•mol-1
下列说法正确的是( )
| A. | 正丁烷的燃烧热为-2878kJ•mol-1 | |
| B. | 正丁烷分子所具有的能量大于异丁烷分子 | |
| C. | 等量的异丁烷分子中碳氢键比正丁烷的多 | |
| D. | 异丁烷转化为正丁烷的过程是一个放热过程 |
| A. |  | B. | CH2=CH-CH=CH2 | C. | 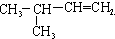 | D. | 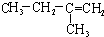 |
| 选项 | 分子式 | 结构或性质 |
| A | C5H10 | 能使溴的CCl4溶液褪色 |
| B | C7H7Br | 含甲基和苯环 |
| C | C5H12O | 能与Na反应生成H2 |
| D | C5H10O2 | 能与碳酸氢钠反应生成CO2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | AgCl不溶于水,不能转化为AgI | |
| B. | 两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{8.5}{\sqrt{1.8}}$×10-12mol•L-1 |
| A. | mg水受热变为mg的水蒸气 | |
| B. | 62g磷和80g氧气反应生成142g五氧化二磷 | |
| C. | 20g食盐溶于80g水得到100g的食盐水 | |
| D. | 拧开盛酒精的瓶盖一段时间后质量变小 |
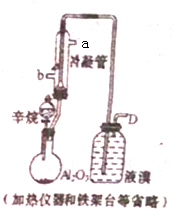 现以C8H18为原理经裂解制得乙烯,进而制得1,2-二溴乙烷,根据如图所示装置,
现以C8H18为原理经裂解制得乙烯,进而制得1,2-二溴乙烷,根据如图所示装置,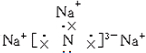 ;该化合物是由离子键形成的离子(填“离子”或“共价”)化合物.
;该化合物是由离子键形成的离子(填“离子”或“共价”)化合物.