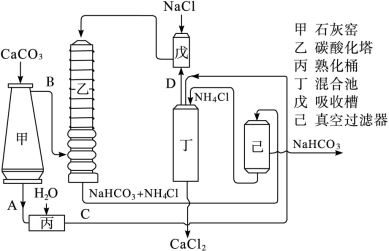
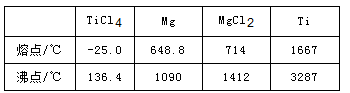
题目内容
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下: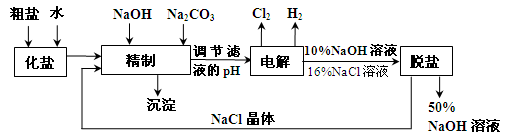
依据上图完成下列问题:
在电解过程中,阴极上生成气体的电子式为 。
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为 。
(3)精制过程要除去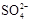 ,可选择下列溶液中的 (填字母序号),并将加入的顺序以箭头符号(↓)的形式画在图上(精制过程中加入试剂从左到右的顺序为先后顺序)。
,可选择下列溶液中的 (填字母序号),并将加入的顺序以箭头符号(↓)的形式画在图上(精制过程中加入试剂从左到右的顺序为先后顺序)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去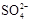 (已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释: 。
(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释: 。
(5)脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 、(填操作名称)而制得50%的NaOH溶液。
(1)H:H
(2)Mg2++2OH-=Mg(OH)2↓
(3)ac 
(4)由于BaSO4比BaCO3的溶解度小,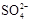 促使BaCO3(s)
促使BaCO3(s) Ba2+(aq)+
Ba2+(aq)+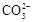 (aq)
(aq)
平衡正向移动,生成更难溶的BaSO4沉淀。
(5)结晶、过滤
解析试题分析:(1)在阴极上氢离子发生还原反应生成H2(2)加入氢氧化钠目的是除去镁离子;(3)除杂满足的原则是除去杂质还不能引入新的杂质,b选项中引入的硝酸根离子没法除去,a中引入的氢氧根离子可通过调节pH而除去,a和c中过量的钡离子都可以通过和碳酸根离子反应而除去,故选a、c;加入碳酸钠一定放在加钡离子之后,用碳酸根离子把过量的钡离子除去;(4)难溶的碳酸钡可以转化成更难溶的硫酸钡;(5)根据信息利用两者溶解性的差异可得分离两者的办法是冷却结晶,氯化钠的溶解度受温度的影响较小,过滤出氢氧化钠晶体,配成氢氧化钠溶液。
考点:考查食盐的净化方法、电极反应的判断、沉淀的转化、冷却结晶等知识

 阅读快车系列答案
阅读快车系列答案下列有关工业生产的叙述中错误的是
| A.电解氯化钠溶液制金属钠 |
| B.石灰石是炼铁和制玻璃的原料之一 |
| C.氯气通入石灰乳中制漂白粉 |
| D.硫酸工业的主要设备有沸腾炉、接触室、吸收塔 |
硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有________(任写一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有________(填写序号)。
| A.矿石加入沸腾炉之前先粉碎 |
| B.使用V2O5作催化剂 |
| C.转化器中使用适宜的温度 |
| D.净化后的炉气中要有过量的空气 |
F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:2SO2(g)+
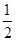 O2(g)
O2(g) 2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体之间进行“对流”。请简单描述吸收塔中反应物之间是怎样对流的。______________________________。
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)
________________________________________________________________________
下列说法不正确的是( )
| A.元素分析仪可同时对有机物中碳、氢、氧、硫等多种元素进行分析,其特点是样品量少,速度快 |
| B.1H核磁共振谱能反映出有机物中不同环境氢原子的种数和个数 |
| C.根据红外光谱图的分析可以初步判断有机物中具有哪些基团 |
| D.同位素示踪法可以用来确定有机反应中化学键的断裂位置 |