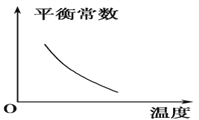
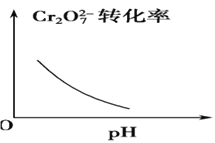
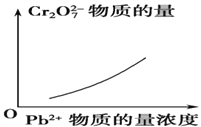
题目内容
【题目】氨的催化氧化是制硝酸的主要反应之一,其微观示意图如下。下列说法正确的是( )

A.甲的化学式为NH3 , 其水溶液呈碱性B.该反应中元素的化合价都发生改变
C.该反应中甲、乙的质量比为17 :32D.生成物丙、丁的分子个数比为1:2
【答案】A
【解析】
首先要对模型图进行观察,分析物质的微观构成、物质的类别,再找出物质之间的微粒数目关系,写出反应的方程式,然后再对题中各问加以分析解答。
依据图示的分子结构可知,该反应的化学方程式为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
A.通过观察题中的图示可知,甲是氨气,其水溶液是氨水,呈碱性,A正确;
B.由方程式和化合价原则可知,该反应中氢元素的化合价没有发生改变,B错误;
C.由方程式可知,该反应中甲、乙的质量比为(17×4):(32×5)=17:40,C错误;
D.由方程式可知,生成物丙、丁的分子个数比为:4:6=2:3,D错误。
故合理选项是A。

练习册系列答案
相关题目
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装 置 |
|
|
|
|
部分实验现象 | a极质量减小;b极质量增加 | b极有气体产生;c极无变化 | d极溶解;c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c