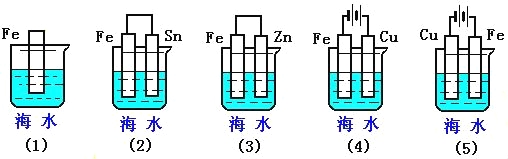
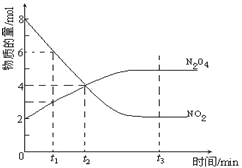
��Ŀ����
����Ŀ������ʽ�о���ѧϰ������ѧ������˼ά�����÷���.ij�о���ѧϰС�齫����װ����ͼ���ӣ�D��F��X��Y ���Dz��缫��C��E�����缫������Դ��ͨ�������е����̪��Һ����F�������Ժ�ɫ���Իش���������:
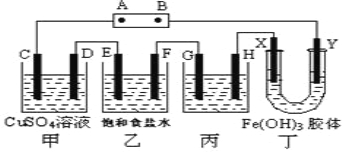
��1����ԴB ����������___________��
��2����װ���е�ⷴӦ���ܻ�ѧ����ʽ��:_________________��
��3����������Һ��������ͬһʱ����C��D�缫�ϲμӷ�Ӧ�ĵ��ʻ����ɵĵ��ʵ����ʵ���֮����__________��
��4�����ñ�װ�ý���ͭ������������п�����ʣ�������G������Ӧ����__________�����ͭ����ͭ���������Һ��ԭ����ʵ����ʵ���Ũ�Ƚ�__________����������С�����䡱����
��5����׳�����Һ������ڵ��ǰ����500ml�����ҳ���������������Ϊ4.48L����״����ʱ���׳������������ʵ����ʵ���Ũ��Ϊ mol/L��
���𰸡���1��������2��CuSO4+ Fe![]() Cu+FeSO4
Cu+FeSO4
��3��1:1��4����ͭ ��С��5��0.4
��������
�����������1����������֪����Դ��ͨ�������е����̪��Һ����F�������Ժ�ɫ����Һ�ʼ��ԣ���FΪ���ص�����������ԴB ����������������
��2����װ��������Ϊ���������缫Ϊ�����������ͭ��Һ����ⷴӦ���ܻ�ѧ����ʽ��CuSO4+ Fe ![]() Cu+FeSO4��
Cu+FeSO4��
��3�����ݣ�2���ķ�Ӧ����ʽ֪ͬһʱ����C���ϲμӷ�Ӧ�������ʵ�����D�缫������ͭ���ʵ����ʵ�����ͬ�����ʵ���֮����1��1��
��4�����ñ�װ�ý���ͭ������������п�����ʣ���������ͭ����������ͭ��������G������Ӧ������ͭ��������ͭ������п�Ƚ���ʧ�������ɽ��������ӽ���������Һ��������ͭ���ӵõ�������ͭ���ʣ����ݵ����غ�֪���Һ��ԭ����ʵ����ʵ���Ũ�Ƚ���С��
��5���ҳ���EΪ������Fe-2e-=Fe2+��FΪ�������缫��Ӧ2H++2e-=H2�������ҳ����������������Ϊ4.48L����״���������ʵ���Ϊ0.2mol���������ҳص���ת��Ϊ0.4mol���׳�����������ʧ���������������ӣ�Fe-2e-=Fe2+��������������Ũ��0.2mol/0.5L=0.4mol/L��

 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д� â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�