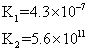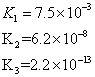题目内容
与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示,K只与温度有关)。下表是几种常见弱酸的电离平衡常数(25℃)。
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH | 1.76×10-5 |
| H2CO3 | H2CO3 HCO3― | K1==4.31×10-7 K2==5.61×10-11 |
| H3PO4 | H3PO4 H2PO4 HPO42 | K1==7.1×10-3 K2==6.3×10-8 K3==4.2×10-13 |
回答下列各题:
(1)温度升高时, (填“促进”或“抑制”)弱酸的电离,K值 (填“增大”、“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱关系是
。
(3)若把CH3COOH、H2CO3、HCO3-、H3PO4、H2PO4、HPO42-都看作是酸,则它们酸性强弱顺序是_________________________________________。
(4)若醋酸的起始浓度为0.010mol/L,则平衡时溶液的pH是多少?(写出计算过程,结果以对数形式表示)
(1)促进、增大
(2)K值越大,酸性越强
(3) H3PO4>CH3COOH>H2CO3>H2PO4> HPO3>HPO42
(4)4- lg4.18

 全优点练单元计划系列答案
全优点练单元计划系列答案液氨常用作制冷剂,回答下列问题
(1)一定条件下在密闭容器中发生反应:
a.NH4I(s) NH3(g) + HI(g)?????? b.2HI(g)
NH3(g) + HI(g)?????? b.2HI(g)  H2(g) + I2(g)
H2(g) + I2(g)
①写出反应a的平衡常数表达式??????????????????
②达到平衡后,扩大容器体积,反应b的移动方向?????? (填“正向”、“逆向”或“不移动”),达到新的平衡时容器内颜色将怎样变化?????? (填“加深”、“变浅”或“不变”)
(2)工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g)? ΔH=-92.60 kJ·mol-1
2NH3(g)? ΔH=-92.60 kJ·mol-1
下列说法能说明上述反应向正反应方向进行的是________(填序号)。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(3)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
???????????????? 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
NH3 | 0 | 0.20 |
| 1.00 | 1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
(4)肼(N2H4)的性质类似于NH3,极易溶于水,与水反应生成一种二元弱碱在溶液中分步电离,请用离子反应方程式表示其水溶液显碱性的原因????????????????????????
氮元素的化合物种类繁多,性质也各不相同。
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:

则NO2氧化SO2的热化学方程式为_________________________________。
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:
2NH3(g) N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
总压强p 100 kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
则平衡时氨气的转化率为___________。
(3)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。在空气中完全燃烧生成氮气,当反应转移0.2mol电子时,生成气体在标准状况下的体积为______________。联氨溶于水可以发生与氨水类似的电离,试写出联氨在水溶液中的电离方程式:
__________________(写一步即可)。
(4)NH4+在溶液中能发生水解反应。在25℃时,0.1mol/L氯化铵溶液由水电离出的氢离子浓度为1×10-5 mol/L,则在该温度下此溶液中氨水的电离平衡常数Kb(NH3·H2O)=__________________。
(6分)与化学平衡类似,电离平衡的平衡常数,叫做电离平衡常数(用K表示, K只与温度有关)。下表是几种常见弱酸的电离平衡常数(25℃)。
| 酸 | 电离方程式 | 电离平衡常数K |
|
|
|
|
|
|
|
|
|
|
|
|
回答下列各题:
(1)温度升高时,______________ (填“促进”或“抑制”)弱酸的电离, K值
______________ (填“增大”、“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱关系是:
________________________________________________________。
(3)若把![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 都看作是酸,则它们酸性强弱顺序是________________________________________________________。
都看作是酸,则它们酸性强弱顺序是________________________________________________________。