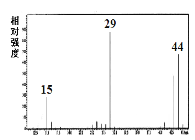
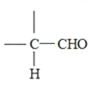
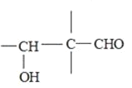
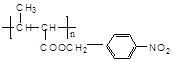题目内容
【题目】利用如图所示装置进行实验,通入![]() 前装置Ⅰ中溶液呈红色。下列说法不合理的是
前装置Ⅰ中溶液呈红色。下列说法不合理的是
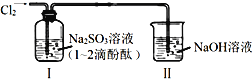
A.通入![]() 后,装置Ⅰ中发生了氧化还原反应
后,装置Ⅰ中发生了氧化还原反应
B.![]() 与
与![]() 溶液反应的离子方程式是:
溶液反应的离子方程式是:![]()
C.通入![]() 后,装置Ⅰ中溶液不褪色
后,装置Ⅰ中溶液不褪色
D.装置Ⅱ的作用是吸收尾气,防止污染空气
【答案】C
【解析】
Na2SO3是强碱弱酸盐,SO32-水解导致溶液呈碱性,Cl2具有强氧化性,能将Na2SO3氧化生成Na2SO4,自身被还原生成氯离子,氯气有毒,不能直接排空,要用碱液吸收,据此分析解答。
![]() 具有强氧化性,能将
具有强氧化性,能将![]() 氧化生成
氧化生成![]() ,自身被还原生成氯离子,所以通入
,自身被还原生成氯离子,所以通入![]() 后,装置Ⅰ中发生了氧化还原反应,故A正确;
后,装置Ⅰ中发生了氧化还原反应,故A正确;
B.![]() 具有强氧化性,能将
具有强氧化性,能将![]() 氧化生成
氧化生成![]() ,自身被还原生成氯离子,所以通入
,自身被还原生成氯离子,所以通入![]() 后,装置Ⅰ中发生了氧化还原反应,反应的离子方程式是:
后,装置Ⅰ中发生了氧化还原反应,反应的离子方程式是:![]() ,故B正确;
,故B正确;
C.亚硫酸钠被氯气氧化生成氯化钠和硫酸钠导致溶液碱性减弱,且氯气和水反应生成的HClO具有漂白性,能使溶液褪色,故C错误;
D.氯气有毒不能直接排空,氯气和水反应生成酸,可以用NaOH溶液处理尾气,故D正确;
故选C。

 阅读快车系列答案
阅读快车系列答案【题目】25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是________________;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反应不能发生的是__________
A.CO32- + CH3COOH = CH3COO- + CO2 ↑ + H2O
B.ClO- + CH3COOH = CH3COO- + HClO
C.CO32- + HClO = CO2 ↑ + H2O + ClO-
D.2 ClO- + CO2 + H2O = CO32-+ 2 HClO
(3)用蒸馏水稀释0.10 mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是__________
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/ KW D.c(H+)/c(OH-)
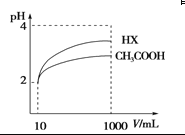
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化 如图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)
【题目】温度分别为T1和T2时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
温度/K | t/min | t1 | t2 | t3 | t4 |
T1 | n(Y)/mol | 0.14 | 0.12 | 0.10 | 0.10 |
T2 | n(Y)/mol | 0.13 | 0.09 | 0.08 |
下列说法正确的是( )
A. 该反应的正反应为放热反应
B. T2温度下此反应的平衡常数K=4
C. 温度为T1时,0~t1时间段的平均速率υ(Z)=2.0×10-3mol·L-1·min-1
D. 在T1下平衡后,保持其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
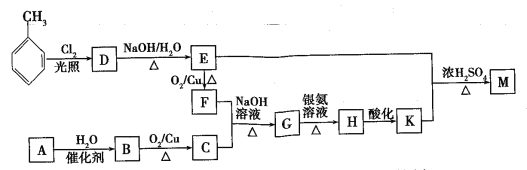
【题目】实验室用环己醇脱水的方法合成环己烯,该实验的装置如下图所示:

可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
按下列实验步骤回答问题:
Ⅰ.产物合成
在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
(l)碎瓷片的作用是________;b的名称是________;
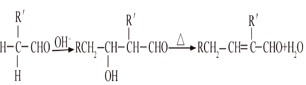
(2)a中发生主要反应的化学方程式为____________________________;本实验最容易产生的有机副产物的结构简式为________。
Ⅱ.分离提纯
将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加人无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为4.1g。
(3)用碳酸钠溶液洗涤的作用是________,操作X的名称为________。
Ⅲ.产物分析及产率计算
(4)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有_______种不同化学环境的氢原子。
② 本实验所得环己烯的产率是_______。
【题目】298K时,碳酸、醋酸和亚硫酸的电离平衡常数见下表:
名称 | 碳酸 | 醋酸 | 亚硫酸 |
电离常数(298K) | K1=4.4×10–7 K2=4.7×10–11 | K=1.8×10–5 | K1=1.3×10–2 K2=6.2×10–8 |
(1)298K时,碳酸、醋酸和亚硫酸,从强到弱的顺序_______________________.(用化学式表示)
(2)用离子方程式表示Na2SO3溶液显碱性的原因_______________________。
(3)25℃时,相同浓度的CH3COONa溶液的碱性________Na2CO3溶液的碱性(填“>”“<”或“=”)。
(4)向醋酸溶液中加少量NaOH溶液,醋酸的电离平衡常数________(填“增大”、“减小”、“不变”).
(5)已知常温下:某NaHSO3溶液的pH=5,则该NaHSO3溶液中c(H2SO3) ________ c(SO32-)(填“>”“<”或“=”).
(6)25℃时,PH=4的亚硫酸溶液与PH=10的NaOH溶液等体积混合后,溶液显_________性.
A.酸性 B.碱性 C.中性 D.无法确定