题目内容
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家.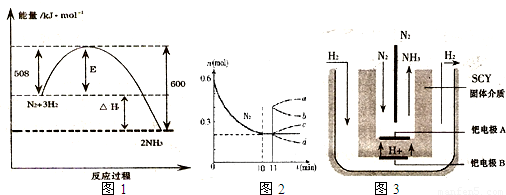
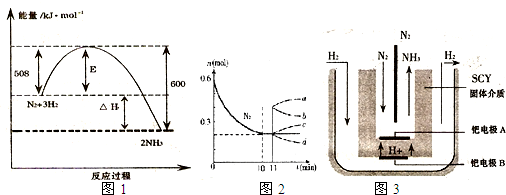
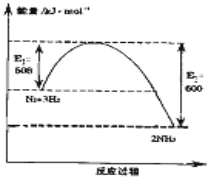
(1)如图1表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
①写出氮气与氢气合成氨的热化学反应方程式:______ 2NH3(g)△H═-92kJ/mol
【答案】分析:(1)①根据图1计算出反应热,写出热化学方程式.注意物质状态,反应热符号等;
②A、根据△H-T△S判断;
B、加入催化剂降低活化能,不影响反应热;
C、该反应为放热反应,升高温度平衡向吸热反应移动;
D、工业合成氨是人工固氮;
(2)①A、催化剂不影响平衡移动;
B、升高温度,平衡向吸热反应方向移动;
C、降低生成物浓度,速率降低,平衡向正反应移动;
D、冲入氮气,增大氮气的浓度,速率加快,平衡向正反应移动;
②根据v=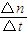 计算v(N2),再根据速率之比等于化学计量数之比计算v(H2);
计算v(N2),再根据速率之比等于化学计量数之比计算v(H2);
压缩体积,增大压强,平衡向正反应移动,改变瞬间n(N2)不变,达平衡是n(N2)减小.
(3)电解池阳极发生氧化反应,阴极发生还原反应,据此判断并写出电极反应式.
解答:解:(1))①由图1可知,1molN2(g)与3molH2(g)完全反应生成2molNH3(g)的反应热为508kJ/mol-600kJ/mol=-92kJ/mol,
所以合成氨的热化学反应方程式为N2(g)+3H2(g) 2NH3(g)△H═-92kJ/mol,
2NH3(g)△H═-92kJ/mol,
故答案为:N2(g)+3H2(g) 2NH3(g)△H═-92kJ/mol;
2NH3(g)△H═-92kJ/mol;
②A、该反应为焓减熵减,△H-T△S<0,反应自发进行,故应在低温下可能自发进行,故A错误;
B、加入催化剂降低活化能,不影响反应热,故B错误;
C、该反应为放热反应,升高温度,平衡向逆反应移动,平衡常数降低,故C正确;
D、工业合成氨是人工固氮,故D正确.
故选:CD;
(2)①A、使用的更高效催化剂,反应加快,不影响平衡移动,故A错误;
B、升高温度,反应加快,平衡向吸热反应移动,即向逆反应移动,故B错误;
C、降低生成物浓度,速率降低,平衡向正反应移动,故C错误;
D、冲入氮气,增大氮气的浓度,速率加快,平衡向体积减小方向移动,即平衡向正反应移动,故D正确.
故选:D;
②由图2可知,0~10min内氮气的物质的量变化为0.6mol-0.2mol=0.4mol,所以v(N2)= =0.02mol/(L?min),
=0.02mol/(L?min),
速率之比等于化学计量数之比,所以v(H2)=3v(N2)=3×0.02mol/(L?min)=0.06mol/(L?min),
压缩体积,增大压强,平衡向正反应移动,改变瞬间n(N2)不变,平衡时n(N2)减小,故选D,
故答案为:0.06mol/(L?min);D;
(3)由图3可知,氮气在铠电极放电生成氨气,所以铠电极为阴极,在电解池中,阴极发生得电子的还原反应,氮气得电子的过程为:N2+6e-+6H+=2NH3,
故答案为:N2+6e-+6H+=2NH3.
点评:本题考查角度广综合性较大,涉及反应热、反应速率、平衡影响因素、电解池等,要求学生具有分析和解决问题的能力,难度大.
②A、根据△H-T△S判断;
B、加入催化剂降低活化能,不影响反应热;
C、该反应为放热反应,升高温度平衡向吸热反应移动;
D、工业合成氨是人工固氮;
(2)①A、催化剂不影响平衡移动;
B、升高温度,平衡向吸热反应方向移动;
C、降低生成物浓度,速率降低,平衡向正反应移动;
D、冲入氮气,增大氮气的浓度,速率加快,平衡向正反应移动;
②根据v=
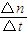 计算v(N2),再根据速率之比等于化学计量数之比计算v(H2);
计算v(N2),再根据速率之比等于化学计量数之比计算v(H2);压缩体积,增大压强,平衡向正反应移动,改变瞬间n(N2)不变,达平衡是n(N2)减小.
(3)电解池阳极发生氧化反应,阴极发生还原反应,据此判断并写出电极反应式.
解答:解:(1))①由图1可知,1molN2(g)与3molH2(g)完全反应生成2molNH3(g)的反应热为508kJ/mol-600kJ/mol=-92kJ/mol,
所以合成氨的热化学反应方程式为N2(g)+3H2(g)
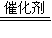 2NH3(g)△H═-92kJ/mol,
2NH3(g)△H═-92kJ/mol,故答案为:N2(g)+3H2(g)
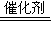 2NH3(g)△H═-92kJ/mol;
2NH3(g)△H═-92kJ/mol;②A、该反应为焓减熵减,△H-T△S<0,反应自发进行,故应在低温下可能自发进行,故A错误;
B、加入催化剂降低活化能,不影响反应热,故B错误;
C、该反应为放热反应,升高温度,平衡向逆反应移动,平衡常数降低,故C正确;
D、工业合成氨是人工固氮,故D正确.
故选:CD;
(2)①A、使用的更高效催化剂,反应加快,不影响平衡移动,故A错误;
B、升高温度,反应加快,平衡向吸热反应移动,即向逆反应移动,故B错误;
C、降低生成物浓度,速率降低,平衡向正反应移动,故C错误;
D、冲入氮气,增大氮气的浓度,速率加快,平衡向体积减小方向移动,即平衡向正反应移动,故D正确.
故选:D;
②由图2可知,0~10min内氮气的物质的量变化为0.6mol-0.2mol=0.4mol,所以v(N2)=
 =0.02mol/(L?min),
=0.02mol/(L?min),速率之比等于化学计量数之比,所以v(H2)=3v(N2)=3×0.02mol/(L?min)=0.06mol/(L?min),
压缩体积,增大压强,平衡向正反应移动,改变瞬间n(N2)不变,平衡时n(N2)减小,故选D,
故答案为:0.06mol/(L?min);D;
(3)由图3可知,氮气在铠电极放电生成氨气,所以铠电极为阴极,在电解池中,阴极发生得电子的还原反应,氮气得电子的过程为:N2+6e-+6H+=2NH3,
故答案为:N2+6e-+6H+=2NH3.
点评:本题考查角度广综合性较大,涉及反应热、反应速率、平衡影响因素、电解池等,要求学生具有分析和解决问题的能力,难度大.

练习册系列答案
相关题目
 氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家
 2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。
2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。 2NH3的反应,左下图表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=_______________。从11min起,压缩容器的体积为
2NH3的反应,左下图表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=_______________。从11min起,压缩容器的体积为


