题目内容
【题目】下面是改良西门子法生产多晶硅的工艺流程。

(1)用惰性电极电解饱和食盐水,写出常温下X与Z反应的化学方程式 。
(2)在合成SiHCl3的过程中,还会有生成副产物SiCl4。已知两物质的沸点分别为57.6℃和31.8℃,则提纯SiHCl3的方法是 。
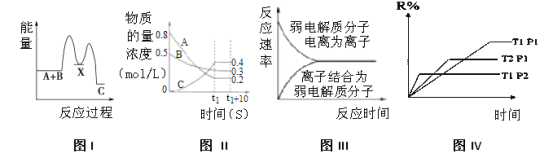
(3)SiHCl3提纯后用H2还原:SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g)。不同温度及不同
Si(s)+3HCl(g)。不同温度及不同![]() 时,反应物X的平衡转化率关系如图图20-1所示。
时,反应物X的平衡转化率关系如图图20-1所示。
X是 (填“H2”或“SiHCl3”)。
②上述反应的平衡常数K(1150℃) K(950℃)(填“>”、“<”或“=”)。
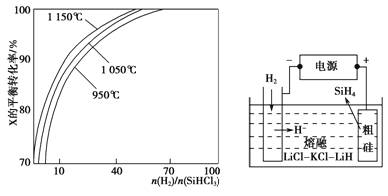
(4)SiH4(硅烷)法生产高纯多晶硅是非常优异的方法。用粗硅作原料,熔融盐电解法制取硅烷原理如图20-2所示,电解时阳极的电极反应式为 。
【答案】
(1)Cl2+2NaOH=NaCl+NaClO+H2O;
(2)蒸馏;
(3)①SiHCl3;②>;
(4)Si+4H--4e-=SiH4↑
【解析】
试题分析:(1)根据流程图,X为NaOH,Y和Z为氢气和氯气,常温下X与Z反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(2)利用沸点的不同提纯SiHCl3,操作为蒸馏,故答案为:蒸馏;
(3)①两种反应物,增加其中一种,另一种物质的转化率增大,自身的转化率反而减小,横坐标表示氢气的量增多,所以纵坐标表示的转化率提高应为SiHCl3,故答案为:SiHCl3;
②当![]() 一定时,温度越高,SiHCl3的转化率高,即反应进行的程度大,所以高温时的化学平衡常数大,则该反应的平衡常数随温度升高而增大,即K(1150℃)>K(950℃);故答案为:>;
一定时,温度越高,SiHCl3的转化率高,即反应进行的程度大,所以高温时的化学平衡常数大,则该反应的平衡常数随温度升高而增大,即K(1150℃)>K(950℃);故答案为:>;
(4)此题类似于电解精炼铜的原理,用粗铜作为阳极,从图示知,H-移向阳极生成SiH4,电极反应式为Si+4H--4e-=SiH4↑,故答案为:Si+4H--4e-=SiH4↑。

【题目】A、B、C、D、E、F是六种常见元素,其中A、B、C、D、E五种元素在周期表中的相对位置如下图所示:
A | B | |||||
C | D | E |
其中B、F形成的二元化合物与D的单质在高温条件下能发生置换反应,该反应可用于焊接铁轨。
回答下列问题:
(1)E在元素周期表中的位置 。
(2)B、C两种元素形成的既含离子键又含共价键的化合物的电子式 。
(3)工业上制备D的单质的方法是电解其 (填字母),阴极反应式为 。
a.氧化物 b.氢氧化物 c.氯化物 d.硫酸盐
(4)常温条件下,向20ml浓度为0.010mol/L的D的氯化物和F的最高价氯化物的混合溶液中逐滴滴入0.020mol/L的NaOH溶液,溶液的pH随着滴入NaOH溶液的变化曲线如图所示:

已知:D和F的最高价氧化物的水化物的溶度积分别为Ksp(D)=1.30×10-33、Ksp(F)=4.0×10-38。
①图像中产生F的最高价氧化物的水化物的沉淀曲线为 (填字母)
a.bc段 b.cd段 c.de段 d.ef段
②沉淀量最大的点为 (填图像中合适的字母)。